��Ŀ����
����Ŀ����ͼ��ʵ���ҳ�������ȡ�����װ�ã� 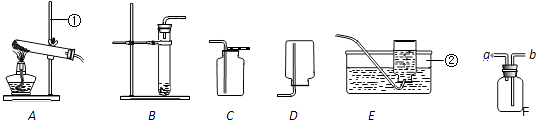
��1��д���������ƣ��ٺ͢ڷֱ��� ��
��2��ʵ�����ø��������ȡ����ʱ�����Թܿ�Ӧ�ŷ�һ������Ŀ���� �� �÷�Ӧ�Ļ�ѧ����ʽ�� ��
��3������װ��B��ȡ����ʱ���Թ���Ӧ�ŵ�ҩƷ�� �� ���ѧ���ƣ�
��4���ռ���������ѡ��װ��C��ԭ���� �� Ҳ����Eװ���ռ��������˷����ռ����������ķ����� ��
��5��ijͬѧʵ������г������Թ����ѵ�������Ԥ����ܵ�ԭ���� ��
��6�������£�������̼��һ����ɫ��ζ�����壬�ܶȱȿ�����������ˮ��ʵ���ҿ��ڳ������ÿ�״��ʯ��ʯ����Ҫ�ɷ���̼��ƣ���ϡ���ᣨ�Ȼ��������ˮ��Һ����Ӧ����ȡ������̼����Ӧͬʱ�������Ȼ��ƺ�ˮ����ʵ������ȡ������̼���壬��ѡ�õķ���װ���� �� �÷�Ӧ�Ļ�ѧ����ʽΪ �� ����Fװ���ռ�������̼������Ӧ�����a����b������ͨ�룮
���𰸡�
��1������̨��ˮ��
��2����ֹ����ʱ������ط�ĩ���뵼�ܣ�2KMnO4 ![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
��3������������Һ�Ͷ�������
��4���������ܶȱȿ����������ǵ�ľ�����ڼ���ƿ�ڣ���ľ����ȼ����
��5���Թܿڳ�����б������ʱ�Թ������ˮ��
��6��B��CaCO3+2HCl=CaCl2+H2O+CO2����b
���������⣺1����������ֱ�������̨��ˮ�ۣ�2���ø�������������Թܿ�Ҫ��һ��������ֹ������ط�ĩ���뵼�ܣ���Ӧ����ʽ�ǣ�2KMnO4 ![]() K2MnO4+MnO2+O2����3������ù���������Һ�������Ͳ���Ҫ���ȣ�ͨ����Ҫ�������������Ϊ�����������Թ��ڷŵ��ǹ���������Һ�Ͷ������̣�4���������������ſ������ռ�������Ϊ�����ܶȱȿ�������Eװ���ռ������������ķ����ǣ��������ǵ�ľ�����ڼ���ƿ�ڣ���ľ����ȼ������5������ʵ�����ü��ȸ�����صķ�����������ʵ��������衢ע��������з���������Թ�ը�ѵ�ԭ������ǣ��Թܿڳ�����б���Թܵײ��Ӵ�����о������ʱ�Թ������ˮ��δ���Թ�Ԥ�ȵȣ�6���ڳ������ÿ�״��ʯ��ʯ��ϡ���ᷴӦ����ȡ������̼�����ڹ�Һ�����ͣ���ѡ����װ��B����Ӧ����ʽ��CaCO3+2HCl=CaCl2+H2O+CO2����������̼�ܶȱȿ���������Ӧ�ӳ��ܽ�����
K2MnO4+MnO2+O2����3������ù���������Һ�������Ͳ���Ҫ���ȣ�ͨ����Ҫ�������������Ϊ�����������Թ��ڷŵ��ǹ���������Һ�Ͷ������̣�4���������������ſ������ռ�������Ϊ�����ܶȱȿ�������Eװ���ռ������������ķ����ǣ��������ǵ�ľ�����ڼ���ƿ�ڣ���ľ����ȼ������5������ʵ�����ü��ȸ�����صķ�����������ʵ��������衢ע��������з���������Թ�ը�ѵ�ԭ������ǣ��Թܿڳ�����б���Թܵײ��Ӵ�����о������ʱ�Թ������ˮ��δ���Թ�Ԥ�ȵȣ�6���ڳ������ÿ�״��ʯ��ʯ��ϡ���ᷴӦ����ȡ������̼�����ڹ�Һ�����ͣ���ѡ����װ��B����Ӧ����ʽ��CaCO3+2HCl=CaCl2+H2O+CO2����������̼�ܶȱȿ���������Ӧ�ӳ��ܽ�����
���Դ��ǣ�1������̨��ˮ�ۣ�2����ֹ����ʱ������ط�ĩ���뵼�ܣ�2KMnO4 ![]() K2MnO4+MnO2+O2����3������������Һ�Ͷ������̣�4���������ܶȱȿ����������ǵ�ľ�����ڼ���ƿ�ڣ���ľ����ȼ������5���Թܿڳ�����б������ʱ�Թ������ˮ�ȣ�6��B��CaCO3+2HCl=CaCl2+H2O+CO2����b��
K2MnO4+MnO2+O2����3������������Һ�Ͷ������̣�4���������ܶȱȿ����������ǵ�ľ�����ڼ���ƿ�ڣ���ľ����ȼ������5���Թܿڳ�����б������ʱ�Թ������ˮ�ȣ�6��B��CaCO3+2HCl=CaCl2+H2O+CO2����b��
�����㾫����������ȡ�����IJ��������ע������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��ȡ�����IJ������裨�Ը��������ȡ����������ˮ���ռ�Ϊ����a�����裺�顪װ�������㡪�ա��ơ�Ϩ��ע�⣺a����ƽ b������ c�����ţ�

����Ŀ����ѧ���ڷ��ӡ�ԭ�Ӳ�����о����ʵ����ʡ���ɡ��ṹ��仯���ɵĿ�ѧ������۩��۩����š�����ϵ�ǻ�ѧѧϰ���ص�֮һ��
��1�����������׳�˫��ˮ�����Ϊ��ɫ��Һ�壬��ˮ��Һ������ҽ���˿�����������������ʳƷ��������ͨ������»�ֽ��ˮ�����������ֽ��ٶȼ���������Ӧ����ʽΪ��2H2O2=2H2O+O2��������ͨ���˷�Ӧ����ʽ��ȡ��������Ϣ�����в���ȷ���� ��
A����������ֽ�����ˮ������
B��ÿ2�����������������2��ˮ���Ӻ�1��������
C��ÿ17�������Ĺ���������ȫ��Ӧ����9��������ˮ��8������������
D��H2O�С�2���ĺ�����2����ԭ��
E���÷�Ӧ����Ԫ����3�ֻ��ϼ�
F������������ˮ��������Ԫ�غ���Ԫ�����
G������������ǻ��������������
H���÷�Ӧ˵������������в��ȶ���
I��������������Ԫ����������Ϊ94.1%������һλС����
J��1�����������������1������Ӻ�1�������ӹ��ɵ�
K����Ӧǰ����Ԫ�ء���Ԫ�ء���ԭ�ӡ���ԭ�ӵĸ�����������û�з����ı�
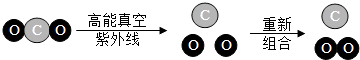
��2�����ͻ�β���е���Ҫ��Ⱦ���ǵ������ij��β�������������ð����뵪���������ѧ��Ӧ��������Ⱦ���ŷţ���Ӧ����ʾ��ͼ��ͼ�� 
��A����Ԫ�غ͵�Ԫ�ص�����������B�Ļ�ѧʽΪ
�ڷ�Ӧ��Ļ�ѧ��Ӧ����ʽΪ ��
��E��B�����Ԫ����ͬ��E����ˮ��Ӧ��B���ܣ�����۽ǶȽ����仯ѧ���ʲ�ͬ��ԭ���� ��
��3��Ԫ�����ڱ���ѧϰ���о���ѧ����Ҫ���ߣ��±���Ԫ�����ڱ��е�һ���֣��Իش�
������ | ��A | ��A | ��A | ��A | ��A | ��A | ��A | O |
2 | 3 Li � | 4 Be ��9.012 | 5 B ��10.81 | �� | 7 N ��14.01 | 8 O ��16.00 | 9 F ��19.00 | 10Ne ��20.18 |
3 | 11Na ��22.99 | �� | 13 Al ��26.98 | 14 Si ��28.09 | �� | 16 S ��32.06 | 17 Cl ��35.45 | 18 Ar �39.95 |
��ԭ������Ϊ10��Ԫ������Ϊ �� ���ԭ������Ϊ��
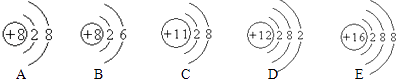
��ͼA��ijԪ�ص�ԭ�ӽṹʾ��ͼ����Ԫ���ڱ��е�λ���ǣ���١������ڡ��ۡ�����
�۽ṹ�������ʣ����ʾ�����;��ͼB����Ԫ�ص�ԭ�ӽṹʾ��ͼ����������Ԫ����ͬһ���еķ�Ԫ�أ���ԭ
�ӽṹ����������������ԭ����ͬ���ɴ��Ʋ⣬��Ԫ����þԪ���γɻ�����Ļ�ѧʽΪ �� ���ɴ����ʵ����ӵķ���Ϊ �� ϡ��������Ϊ��ѧ������������������������