题目内容
25)鸡蛋壳的主要成分为碳酸钙。为了测定鸡蛋壳中钙的质量分数,小华同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10 g放在烧杯里,然后往烧杯中滴加足量的稀盐酸,加入稀盐酸的量与生成气体的量如图所示。试求该鸡蛋壳中钙元素的质量分数。(假设鸡蛋壳中其他物质不与盐酸反应)
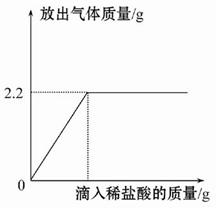
由题意知,盐酸足量,故鸡蛋壳中的碳酸钙完全反应,分析图示知,完全反应后,二氧化碳的值最大为2.2 g,可根据二氧化碳的量求出鸡蛋壳中碳酸钙的质量,然后再根据化学式求出鸡蛋壳中钙元素的质量分数。
答案:解:设所取鸡蛋壳中碳酸钙的质量为x,根据图示其完全反应时生成的CO2为2.2 g。
CaCO3+2HCl====CaCl2+CO2↑+H2O
100 44
x 2.2 g
 x=
x=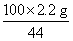 =5 g
=5 g
碳酸钙中钙元素的质量分数为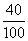 ×100%=40%,
×100%=40%,
所取鸡蛋壳中钙元素的质量分数=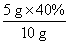 ×100%=20
×100%=20 %。
%。
答:略。

练习册系列答案
相关题目
在酸性条件下,次氯酸钠(NaClO)、过氧化氢(H2O2)都有很强的氧化性,可将Fe2+氧化为Fe3+;在溶液中,Mg(OH)2和Fe(OH)2呈胶状物或絮状物沉淀;而MgCO3在水中煮沸可转化为更难溶的Mg(OH)2.
“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按图所示的工艺流程即可制得“轻质氧化镁”.并要求产品尽量不含杂质离子,而且成本较低,流程中加入的物质及其pH控制,都可参考下表1、表2来确定.

表1 生成氢氧化物沉淀时的pH
表2工业品价格
请根据以上信息填写下列空白:
(1)写出在盐酸溶液中,NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水的化学方程式 ;
同时H2O2将FeCl2氧化成FeCl3,并生成了水,其化学方程式 .
(2)在步骤②中加入的物质X,最佳的选择应是 ,理由是 .
(3)在步骤③中加入的物质Y应是 ,之所以要控制pH=9.8,其目的是 .
(4)在步骤④中加入的物质Z应是 .
(5)在步骤⑤时发生的化学反应方程式是 .
“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按图所示的工艺流程即可制得“轻质氧化镁”.并要求产品尽量不含杂质离子,而且成本较低,流程中加入的物质及其pH控制,都可参考下表1、表2来确定.

表1 生成氢氧化物沉淀时的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元.╱吨) |
| 漂液 | 含NaClO 25.2% | 450 |
| 过氧化氢 | 含H2O230% | 240 |
| 烧碱 | 含NaOH 98.5% | 2100 |
| 纯碱 | 含Na2CO399.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
(1)写出在盐酸溶液中,NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水的化学方程式
同时H2O2将FeCl2氧化成FeCl3,并生成了水,其化学方程式
(2)在步骤②中加入的物质X,最佳的选择应是
(3)在步骤③中加入的物质Y应是
(4)在步骤④中加入的物质Z应是
(5)在步骤⑤时发生的化学反应方程式是
食盐、食醋、纯碱均为家庭厨房中常用的物质.利用这些物质不能完成的实验是( )
| A、鉴别食盐和纯碱 | B、验证蛋壳的主要成分为CaCO3 | C、除去热水瓶内壁上的水垢 | D、检验自来水中是否含有Cl- |