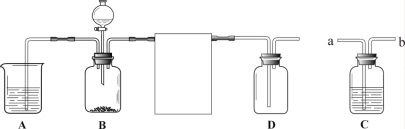
��Ŀ����
����Ŀ��ʪ��ұͭ���ŷŵķ�ˮ�к������������ͭ������Ⱦ�Ϊ�ⶨ�÷�ˮ�и���Ⱦ��ĺ���������С���ͬѧ����������ʵ�顣ȡ��ˮ500g�������м���������������Ϊ20��������������Һ����ó��������������������������Һ��������ϵ��ͼ�������������ݼ��㣺
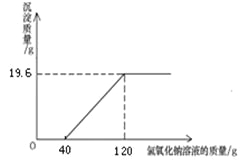
��500g��ˮ�м�������������Һ��ַ�Ӧ�õ����������ʵ����� mol��
�ڸ÷�ˮ������ͭ������������������д��������̣�
�۸÷�ˮ����������ʵ����� ��
���𰸡���8�� 0.2mol
��9�����ˮ�� CuSO4ΪXmol
CuSO4+2NaOH ====Cu��OH��2��+Na2SO4
1 1
X 0.2
X= 0.2mol
CuSO4%=160��0.2/500g=6.4%
��10��0.1mol
�������������������8������ͼʾ��֪��������ͭ�����ʵ���=19.6g/98=0.2mol����9�����ݻ�ѧ����ʽ���������ͭ�����ʵ�����Ȼ������������������ͭ����Է����������ó�����ͭ���������������ͭ������������ͭ��Һ�������ɵó���ˮ������ͭ������������������10������ͼʾ��֪�������ᷴӦ������������Һ����Ϊ40�ˣ����ݻ�ѧ����ʽ����������������ɡ����岽�����£�
�⣺����������ΪX
�����ᷴӦ��������������=40����20%=8g
2NaOH +H2SO4="=" Na2SO4+2H2O
80 98
8g X
80/98=8g/X X=9.8g
��÷�ˮ����������ʵ���=9.8g/98=0.1mol
����

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�