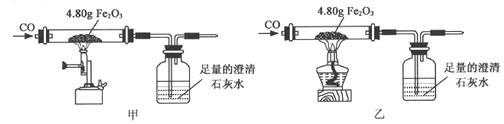
题目内容
【题目】 如图是配制50g溶质质量分数为5%的NaCl溶液的实验操作示意图。结合图示回答下列问题:
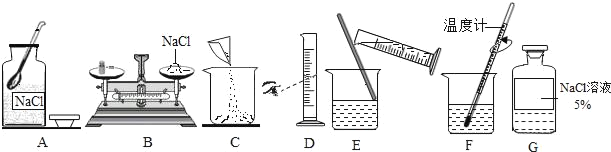
(1)请找出图中的错误加以改正(写出三处即可):
①_____;②_____;③_____。
(2)需要称量氯化钠质量是_____g,在用托盘天平称量氯化钠固体时,如果1g以下使用游码,如果甲同学按照B操作,其他操作都正确,所配得溶液的溶质质量分数为_____。(计算结果精确至1%)
(3)需要水的质量是_____g,配制时应选择_____(填“10”或“50”)mL的量筒。量取水时,如果乙同学按照图D笔法读数,配制的其余操作准确规范,则所得溶液溶质质量分数_____(填“小于”、“等于”或“大于”)5%
(4)丙同学配制的上述溶液,经测定其氯化钠质量分数大于5%,下列可能原因有_____。(填字母序号)
A.用量筒取水时俯视读数
B.用来配制溶液的烧杯刚用少量蒸馏水润洗过
C.用托盘天平称取氯化钠时,将氯化钠放在右盘,且称量时使用了游码
D.把量好的水倒入烧杯时,有少量水溅出烧杯
(5)通过以上过程可知,配制一定溶质质量分数的溶液,三个主要步骤依次是_____、_____、_____、装瓶并贴标签。
【答案】B中右盘放砝码,左盘放氯化钠 D中视线应与凹液面最低处保持水平 F中应用玻璃棒搅拌 2.5 3% 47.5 50 小于 AD 计算 称量 溶解
【解析】
(1)①B中右盘放砝码,左盘放氯化钠;②D中视线应与凹液面最低处保持水平;③F图中用温度计搅拌是错误的。
(2)需要称量氯化钠的质量=50×5%=2.5g;如果甲同学按照B操作,其他操作都正确,实际称量的食盐结果是2-0.5=1.5 g,实验最终的溶液质量为50-(2.5-1.5)=49 g,则所得溶液的溶质质量分数=![]() ;
;
(3)需要水的质量=50-2.5=47.5g,为减少误差所以选用50 mL的,如果乙同学按照图D方法读数,配制的其余操作准确规范,这种读数方式会使得量取的水多了,则所得溶液的溶质质量分数就会减小。
(4)用量筒取水时俯视读数和在把量好的水倒入烧杯时,有少量水溅出烧杯,都是使得溶剂的量减少,使氯化钠质量分数大于5%,故选AD。
(5)配制一定溶质质量分数的溶液,三个主要步骤依次是计算、称量、溶解。

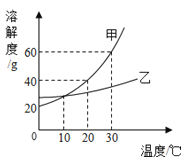
【题目】MgSO4和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度 S/g | MgSO4 | 33.7 | 38.9 | 44.5 | 50.6 | 54.6 | 55.8 |
Na2SO4 | 19.5 | 40.8 | 48.8 | 47.5 | 45.3 | 44.8 | |

A. 甲为Na2SO4
B. t3℃应介于40℃~50℃之间
C. t4℃乙的饱和溶液,降温到t1℃的过程中,一直有晶体析出
D. b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数
【题目】酸、碱、盐是九年级化学学习的重要知识,并且它们具有广泛的用途。
(1)下列关于酸、碱、盐的说法正确的是________________。
A 酸与金属都能反应生成盐和氢气 B 能够生成盐和水的反应都叫做中和反应
C 酸和碱都含有氢元素 D 酸、碱、盐之间都能发生复分解反应
(2)酸和碱之间能够发生中和反应,康康向滴有酚酞的氢氧化钠溶液中逐滴加入稀盐酸,该反应的化学方程式为________________;若滴加一定量稀盐酸后溶液变为无色,测得反应后溶液的 pH=6,则溶液中存在的阳离子为________________ (填离子符号)。
(3)某白色固体中可能含有碳酸钠、硝酸钡、氢氧化钠、硫酸铜中的一种或几种,为确定该固 体成分,现进行以下实验:
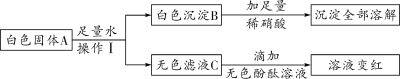
①根据上述实验分析,A 中一定含有的物质是________________,C 中一定含有的溶质是
________________。
②为进一步确定固体 A 中可能存在的物质,对滤液 C 进行实验,完成下表。
实验操作 | 现象 | 结论 |
________________ | ________________ | A中有氢氧化钠 |
(4)将 50 g 稀盐酸加入 50 g 氢氧化钠溶液中恰好完全反应,所得溶液中溶质的质量分数 为 5.85%。试计算氢氧化钠溶液中溶质的质量分数。________________