题目内容
19、冬季,大雪覆盖路面,给交通造成很多麻烦,撒融雪剂可以使雪很快融化,有效地清除交通雪障.氯化钙是常用的融雪剂.工业上以碳酸钙(含有少量Na+、A13+、Fe3+杂质)生产氯化钙的主要流程如下.请回答:
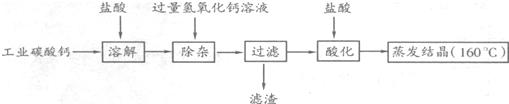
(1)加过量氢氧化钙的目标是
(2)加盐酸酸化,其目的

(1)加过量氢氧化钙的目标是
除去杂质离子A13+和Fe3+
,写出这里发生反应的一个化学方程式3Ca(OH)2+2FeCl3═2Fe(OH)3↓+3CaCl2或3Ca(OH)2+2AlCl3═2Al(OH)3↓+3CaCl2
.(2)加盐酸酸化,其目的
除去过量的Ca(OH)2
.分析:(1)根据碳酸钙中含有的杂质分析,加入过量氢氧化钙能把杂质离子沉淀出了,根据反应物和生成物按照书写化学方程式的步骤完成化学方程式;
(2)根据盐酸的性质和实验过程中物质的成分进行推断,即可正确解答;
(3)根据图示和已知条件,逐一分析,即可正确解答.
(2)根据盐酸的性质和实验过程中物质的成分进行推断,即可正确解答;
(3)根据图示和已知条件,逐一分析,即可正确解答.
解答:解:(1)碳酸钙中含有少量A13+、Fe3+杂质,加入过量的氢氧化钙和生成氢氧化铝沉淀和氢氧化铁沉淀,把杂质除去;反应的化学方程式为:3Ca(OH)2+2FeCl3═2Fe (OH)3↓+3CaCl2或3Ca(OH)2+2AlCl3═2Al(OH)3↓+3CaCl2(2)在第二次操作中加入了过量氢氧化钙溶液,后面加入盐酸酸化的目的就是除去多余的氢氧化钙;
故答案为:(1)除去杂质离子A13+和Fe3+3Ca(OH)2+2FeCl3═2Fe (OH)3↓+3CaCl2或3Ca(OH)2+2AlCl3═2Al(OH)3↓+3CaCl2
(2)除去过量的Ca(OH)2
故答案为:(1)除去杂质离子A13+和Fe3+3Ca(OH)2+2FeCl3═2Fe (OH)3↓+3CaCl2或3Ca(OH)2+2AlCl3═2Al(OH)3↓+3CaCl2
(2)除去过量的Ca(OH)2
点评:此题主要是考查同学们的综合分析能力,不但要求同学们具备有关物质的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断.

练习册系列答案
相关题目
冬季,大雪覆盖路面,给交通造成很多麻烦,散撒融雪剂可以使雪很快融化,有效地清除交通雪障。请回答:(1)除使用融雪剂外,常使用铲雪车铲雪,铲雪车的铲斗是用锰钢制造的,锰钢属于 (填写序号字母)。
| A.合成材料 | B.合金 | C.金属材料 | D.化合物 |
(2)氯化钙是常用的融雪剂。工业上以碳酸钙(含有少量Na+、A13+、Fe3+等杂质)生产氯化钙的主要流程如下:
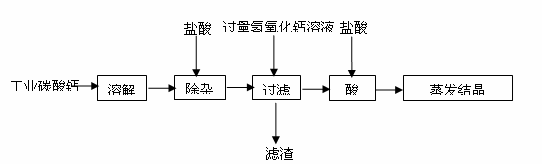
①滤渣的主要成分是 (填化学式);
②加盐酸酸化,其目的之一是除去未反应的氢氧化钙,写出反应的化学方程式 。
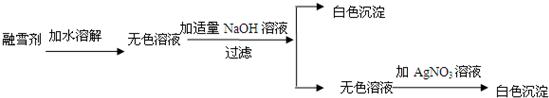
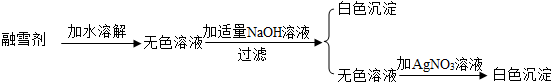
(3)已知盐酸盐(金属氯化物)跟AgNO3溶液反应生成白色沉淀。某公司生产的融雪剂由NaCl、NaNO3、MgCl2、CuSO4中的两种物质组成。小明为探究其成分,设计并完成下列实验:
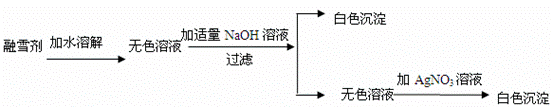
请你推断:融雪剂中一定不含的物质是 ,融雪剂中一定含有的物质是 ,可能含有的物质是______________________(上面三空都填化学式)