题目内容
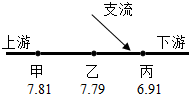 (2012?南平)实验小组对某河水的酸碱性进行调查,确定三处采样点(如示意图,其数值为该处河水的pH).
(2012?南平)实验小组对某河水的酸碱性进行调查,确定三处采样点(如示意图,其数值为该处河水的pH).(1)三处采样点中,水质碱性最强的采样点是
甲
甲
(2)分析数据发现,采样点丙的酸碱度因支流小溪水的汇入而变化较大,可推知支流小溪水呈
酸性
酸性
(填“酸性”或“碱性”或“中性”).(3)支流小溪水是硬水,可在水样中滴加
肥皂水
肥皂水
来检验.(4)支流小溪水含有较多的钙离子(以CaCl2形式存在),工业上常采用离子交换树脂(HR)来去除,发生的化学反应是:2HR+CaCl2═CaR2+2X,X的化学式是
HCl
HCl
.分析:(1)当溶液的pH等于7时,呈中性;当溶液的pH大于7时,呈碱性;当溶液的pH小于7时,呈酸性.当溶液的pH大于7时,随着pH的增大碱性增强.
(2)乙处的pH=7.79,显弱碱性,丙处的pH=6.91,显弱酸性,因此可推知支流小溪水呈酸性;
(3)硬水和软水的区别在于所含的钙镁离子的多少,区分硬水和软水常用的方法是用肥皂水,据此分析分析判断.
(4)根据化学变化前后原子的种类、数目不变分析.
(2)乙处的pH=7.79,显弱碱性,丙处的pH=6.91,显弱酸性,因此可推知支流小溪水呈酸性;
(3)硬水和软水的区别在于所含的钙镁离子的多少,区分硬水和软水常用的方法是用肥皂水,据此分析分析判断.
(4)根据化学变化前后原子的种类、数目不变分析.
解答:解:(1)甲、乙、丙三处中甲的pH最大,因此甲处水质碱性最强;
(2)乙处的pH=7.79,显弱碱性,丙处的pH=6.91,显弱酸性,因此可推知支流小溪水呈酸性;
(3)可用肥皂水来区分硬水和软水,产生泡沫较多的是软水,较少的硬水;
(4)由反应的化学方程式2HR+CaCl2═CaR2+2X,可得知反应前后各原子的个数为:
反应前 反应后
R原子 2 2
氢原子 2 0
钙原子 1 1
氯原子 2 0
根据化学变化前后原子的种类、数目不变,可推断2个X的分子中含有2个氢原子和2个氯原子,则每个X分子由1个氢原子和1个氯原子构成,物质X的化学式为HCl;
故答案为:(1)甲;(2)酸性;(3)肥皂水;(4)HCl.
(2)乙处的pH=7.79,显弱碱性,丙处的pH=6.91,显弱酸性,因此可推知支流小溪水呈酸性;
(3)可用肥皂水来区分硬水和软水,产生泡沫较多的是软水,较少的硬水;
(4)由反应的化学方程式2HR+CaCl2═CaR2+2X,可得知反应前后各原子的个数为:
反应前 反应后
R原子 2 2
氢原子 2 0
钙原子 1 1
氯原子 2 0
根据化学变化前后原子的种类、数目不变,可推断2个X的分子中含有2个氢原子和2个氯原子,则每个X分子由1个氢原子和1个氯原子构成,物质X的化学式为HCl;
故答案为:(1)甲;(2)酸性;(3)肥皂水;(4)HCl.
点评:解答本题要掌握溶液的酸碱性和溶液pH大小之间的关系、硬水和软水的区别以及质量守恒定律,然后再根据题中信息分析即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
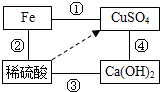 (2012?南平)如图实线“--”表示相连的两种物质间会发生化学反应,据图回答:
(2012?南平)如图实线“--”表示相连的两种物质间会发生化学反应,据图回答: