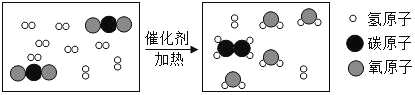
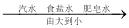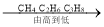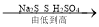��Ŀ����
�������������������й㷺Ӧ�á�
��1���ҹ���ˮ�꾮ƽ̨��981���ø�����3��֣�¶��ƽ̨�ĸֺ��������⣬�������Ҫ�ɷ���____________���ѧʽ����д���������ȥ����Ʒ��������Ļ�ѧ����ʽ____________��
��2�����к����ʵij�������Ҫ�ɷ�Ϊ Fe2O3����Ʒ��Ϊ�˲ⶨ����Ʒ��������������������ijͬѧȡ����Ʒ 5.0g����ͬѧ��ʵ������һ����̼��ԭ���������ʲ��μӷ�Ӧ����װ��ʾ��ͼ���£�
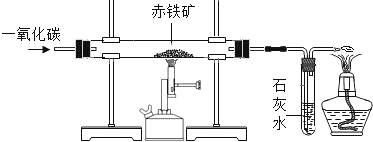
����ֱ�ι��ڷ�����Ӧ�Ļ�ѧ����ʽ�ǣ�____________��
�����й��ڸ�ʵ��IJ���������ȷ����_________________��
A��ʼʱӦ��Ԥ�Ȳ����ܣ���ͨ��һ����̼
B��Ӧ���̿ɹ۲쵽�����ɺ�ɫ���
CʢװҩƷǰӦ�ȼ��װ��������
D��β����ȼ���ռ����ɷ�ֹһ����̼��Ⱦ����
����Ʒ��ַ�Ӧ�ⶨʵ�����ݣ�����ʯ��ˮ���� 3.3g.���㣺
I.��Ӧ���� CO2 ��������____________��
II.����Ʒ��������������������____________��
��3��ij��ѧ��ȤС��ͬѧ��ʵ���ҽ�һ��������п�۷���ʢ��������������ͭ������þ�Ļ����Һ�У���ַ�Ӧ����ˣ��õ���������Һ����Һ����ɫ��
��������һ�����еĽ�����____________��
����Һ��һ�����е���������_______________��
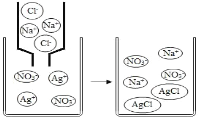
Ϊ̽������Ļ�ѧ���ʣ�ij��ѧС����������ʵ�飺

��1��������Ӧ�������������Ϊ_______________������ĸ��ţ���ͬ���������ݲ�������____________��B �Թ�����������Ӧ�Ļ�ѧ����ʽΪ____________��
��2������Ӧ�� D �� E �Թ��еķ�Һ����һ�ྻ���ձ��У��۲쵽�ձ����������ݲ��������а�ɫ�������֡����ձ��еĻ������ˣ��õ���ɫ��������ɫ��Һ��ͬѧ�Ƕ���Һ�����ʵijɷֽ��� ̽����
�������ϵ�֪��CaCl2+Na2CO3=2NaCl+CaCO3����Na2CO3+2HCl=2NaCl+H2O+CO2 ��
��
��������⣩��Һ�����ʵijɷ���ʲô��
����������룩����һ��NaCl���������NaCl �� CaCl2 ����������NaCl��Ca(OH)2 �� HCl�������ģ�____________��
�������뽻���������ۣ�ͬѧ��һ����Ϊ����____________�Ǵ���ġ�
��ʵ������ۣ�
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Һ���Թ��У��μ�����̼������Һ | ������ | ������ ���� |
ȡ������Һ���Թ��У��μ�����_____________ | ____________ |
����չ��Ǩ�ƣ�ϡ�����ϡ���������ƵĻ�ѧ���ʣ�����Ϊ���ǵ���Һ�ж�����____________��