题目内容
(7分)现有某不纯的碳酸钠固体样品,已知其中含有的杂质可能是Na2SO4、CuSO4、NaCl、CaCl2中的一种或几种。为确定其杂质的成分,进行如下实验,出现的现象如图所示(设过程中所有发生的反应都恰好完全进行)。
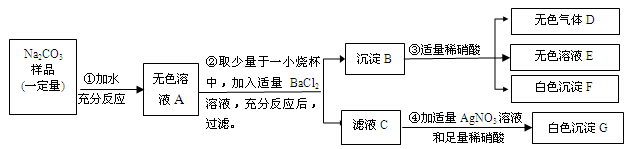
请你根据实验过程和发生的现象做出分析判断,并填写以下空白:
(1)气体D能使紫色石蕊试液 。
(2)无色溶液E中的酸根离子的符号是 。
(3)该碳酸钠固体样品中一定含有的杂质是 ,一定不含有的杂质是 。
(4)请写出过程④中发生反应的一个化学方程式 。
(5)碳酸钠固体样品中还不能确定的物质是 。要确定它是否存在,可另取溶液A再实验。请简述你的设计方案(说明实验操作步骤、发生的现象及结论)。
。

请你根据实验过程和发生的现象做出分析判断,并填写以下空白:
(1)气体D能使紫色石蕊试液 。
(2)无色溶液E中的酸根离子的符号是 。
(3)该碳酸钠固体样品中一定含有的杂质是 ,一定不含有的杂质是 。
(4)请写出过程④中发生反应的一个化学方程式 。
(5)碳酸钠固体样品中还不能确定的物质是 。要确定它是否存在,可另取溶液A再实验。请简述你的设计方案(说明实验操作步骤、发生的现象及结论)。
。
(1)变红色; (2)NO3—; (3)Na2SO4;CuSO4、CaCl2;
(4)NaCl+AgNO3=AgCl↓+NaNO3; (5)取少量溶液A于试管中,加入足量硝酸钡溶液,充分反应后过滤,再向滤液中加入适量硝酸银溶液和稀硝酸。若产生白色沉淀,则说明碳酸钠固体样品中含有氯化钠;若无明显现象,说明不含氯化钠。
(4)NaCl+AgNO3=AgCl↓+NaNO3; (5)取少量溶液A于试管中,加入足量硝酸钡溶液,充分反应后过滤,再向滤液中加入适量硝酸银溶液和稀硝酸。若产生白色沉淀,则说明碳酸钠固体样品中含有氯化钠;若无明显现象,说明不含氯化钠。
试题分析:根据题意可知:沉淀B与稀硝酸混合后,生成的气体D为二氧化碳气体;沉淀F不溶于稀硝酸,为硫酸钡。所以原沉淀B为碳酸钡和硫酸钡的混合物。则原样品中一定含硫酸根。
(1)气体D为二氧化碳,与水反应生成碳酸,能使紫色石蕊试液变红色。
(2)碳酸钡与硝酸反应生成的硝酸钡、二氧化碳和水;所以无色溶液E是由酸根离子为硝酸根离子,符号是NO3—。
(3)样品加水后可得无色溶液A,可排除硫酸铜(蓝色)和氯化钙(可与碳酸钠反应生成碳酸钙沉淀)。因原样品中一定含硫酸根,所以一定含的物质为硫酸钠。
(4)在步骤②中碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠。所以④中发生反应可为氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,化学方程式为:NaCl+AgNO3=AgCl↓+NaNO3。
(5)因步骤②中加入了氯化钡,所以无法确定步骤④中生成的沉淀是否是由原固体中的氯化钠反应生成。所以还不能确定的物质是氯化钠。根据上述分析可知,原样品中一定存在的物质为碳酸钠、硫酸钠;为检验氯化钠是否存在,可另取溶液A:加入足量硝酸钡溶液,充分反应后过滤(除去碳酸钠和硫酸钠)。再向滤液中加入适量硝酸银溶液和稀硝酸。若产生白色沉淀,则说明碳酸钠固体样品中含有氯化钠;若无明显现象,说明不含氯化钠。

练习册系列答案
相关题目