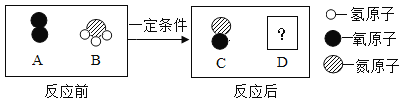
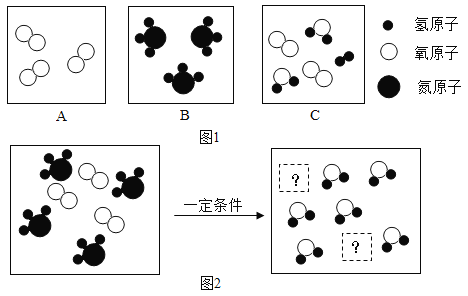
��Ŀ����
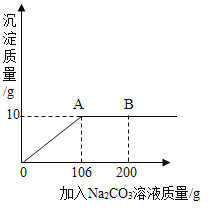
����Ŀ���Ȼ��Ƽ�ʯ�Ļ�ѧʽΪKCl��xCaC12(x��CaCl2��ϵ��)������һ����Ȼ�ļطʣ�����ˮ��õ�KCl��CaCl2�Ļ����Һ��ij��ѧ��ȤС��Ϊ�˲ⶨ�Ȼ��Ƽ�ʯ�м�Ԫ�ص�������������ȡ��Ʒ18.55g��ˮ��ȫ�ܽ�õ�KCl��CaCl2�Ļ����Һ�������Һ����μ���Na2CO3��Һ�������ij��������Na2CO3��Һ��������ϵ����ͼ��ʾ����ش��������⣺
(1)д��Na2CO3��CaCl2��Ӧ�Ļ�ѧ����ʽ______��
(2)ͼ��AB�α�ʾ��������_________��
(3)18.55g�Ȼ��Ƽ�ʯ��Ʒ�У�
��CaCl2��������______g��
��KCl��������____g��
�ۼ�Ԫ�ص�����������______��
(4)����Na2CO3��Һ�����ʵ����������Ƕ���?(���һ��Ҫ��д���������)____________
���𰸡�Na2CO3+CaCl2=CaCO3��+2NaCl CaCl2����ȫ��Ӧ����Na2CO3��Һ���� 11.1 7.45 21.0% 10%
��������
��1��̼�������Ȼ��ƶ������������ʣ������οɷ������ֽⷴӦ��̼�������Ȼ��ƽ����ɷ�����̼��Ƴ������⻯�ƣ�
��2��ͼ��AB�γ����������䣬˵����Һ�е��Ȼ�������ȫ��Ӧ�������̼������Һ���������ٷ�����Ӧ��
��3������̼�������Ȼ������ɵ�̼��Ƴ�����������μӷ�Ӧ���Ȼ��Ƶ���������Ʒ�������Ȼ���������Ȼ��ص��������Ȼ����м�Ԫ����������Ʒ�����ȿɼ�����Ʒ�м�Ԫ�ص�����������
��4������ǡ����ȫ��Ӧʱ�������106g̼������Һ�е�̼������������Һ�����ȼ���������Һ��������������������̼���Ƶ������ɸ��ݷ�Ӧ�Ļ�ѧ����ʽ�����ɵij���̼��Ƶ��������㣮
��1�������̼��������Һ���Ȼ��ƽ����ɷ֣����γɳ�����������Ӧ������̼��Ƴ������Ȼ��ƣ���ѧ����ʽΪNa2CO3+CaCl2=CaCO3��+2NaCl��
��2��AB�γ���̼��Ƶ�����û�иı䣬��ʾ��Һ���Ȼ�������ȫ��Ӧ�����������̼������Һ������
��3����ǡ����ȫ��Ӧ����10g̼��Ƴ���ʱ�����Ȼ��Ƶ�����Ϊm��
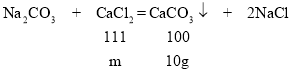
![]()
���m=11.1g
18.55g�Ȼ��Ƽ�ʯ��Ʒ��KCl������=18.55g-11.1g=7.45g
18.55g�Ȼ��Ƽ�ʯ��Ʒ�м�Ԫ�ص���������=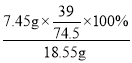 ��100%��21.0%
��100%��21.0%
��4����106gNa2CO3��Һ��Na2CO3������Ϊx
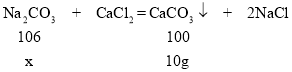
![]() =
=![]()
���x=10.6g
������Na2CO3��Һ��Na2CO3����������=![]() ��100%=10%
��100%=10%
������Na2CO3��Һ��Na2CO3����������Ϊ10%

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д� ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д�����Ŀ�����л�ѧ���������ȷ���Ҽ��к�����壬�������������
ѡ�� | �� �� | ��ѧ���� |
A | �ؿ��к������Ľ���Ԫ�� | AL |
B | �����ǵĻ�ѧʽ | C6H12O6 |
C | ����������Һ�Ͷ������̻�������� | H2O2 |
D | �����ӵķ��� | Cl1- |
A. A B. B C. C D. D