题目内容
【题目】水是重要的物质,在实验室中常用于溶解物质、配制溶液.
(1)向50mL水(密度为1g/mL)中溶解一定量KNO3固体的操作如下,请根据如图实验现象和溶解度曲线回答. 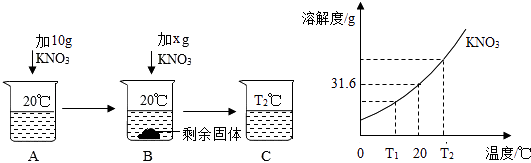
①A,B,C中一定是饱和溶液的是 , 一定是不饱和溶液的是;(填字母)
②当x=g时,B中恰好没有固体剩余;
③硝酸钾从溶液中析出晶体常用方法.
(2)根据下列仪器,欲配制一定质量分数的食盐溶液,回答下列问题. 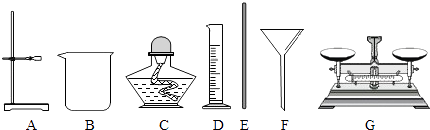
①上面的仪器中除D,E外,还必须选用的仪器有;(填字母)
②E的作用是 , 配制的步骤可以概括为计算、称取和量取、、装瓶贴标签.
【答案】
(1)B;A;5.8;降温结晶或冷却热的饱和溶液
(2)BG;加快固体的溶解速率;溶解
【解析】解:①据图可以看出,B中有剩余的固体,故B一定是饱和溶液;A中加入5g硝酸钾形成的溶液继续加入硝酸钾还能继续溶解,说明A是不饱和溶液;B升高温度后得到的C溶液可能饱和也可能不饱和;②在20℃时,硝酸钾的溶解度是31.6g,则20℃时50mL即50g水中最多溶解硝酸钾的质量是 ![]() =15.8g,故x=15.8g﹣10g=5.8g;③x硝酸钾的溶解度随温度的升高而增大,所以硝酸钾从溶液中析出晶体常用降温结晶或冷却热的饱和溶液方法;(2)①上面的仪器中除D、E外,还必须选用的仪器有烧杯和天平;②E的作用是加快固体的溶解速率,配制的步骤可以概括为计算、称取和量取、溶解、装瓶贴标签所以答案是:(1)①B;A; ②5.8;③降温结晶或冷却热的饱和溶液;(2)BG;加快固体的溶解速率;溶解.
=15.8g,故x=15.8g﹣10g=5.8g;③x硝酸钾的溶解度随温度的升高而增大,所以硝酸钾从溶液中析出晶体常用降温结晶或冷却热的饱和溶液方法;(2)①上面的仪器中除D、E外,还必须选用的仪器有烧杯和天平;②E的作用是加快固体的溶解速率,配制的步骤可以概括为计算、称取和量取、溶解、装瓶贴标签所以答案是:(1)①B;A; ②5.8;③降温结晶或冷却热的饱和溶液;(2)BG;加快固体的溶解速率;溶解.
【考点精析】解答此题的关键在于理解结晶的原理、方法及其应用的相关知识,掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3),以及对饱和溶液和不饱和溶液的理解,了解饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解.

【题目】下列方法不能把待鉴别的物质区分开的是( )
选项 | 待鉴别的物质 | 鉴别方法 |
A | 氯化钾和碳酸钡固体 | 水 |
B | 稀硫酸和氯化钠溶液 | 加酚酞 |
C | Cu粉与CuO粉末 | 稀硫酸 |
D | 棉纤维、羊毛纤维 | 点燃,闻燃烧产生的气味 |
A.A
B.B
C.C
D.D