题目内容
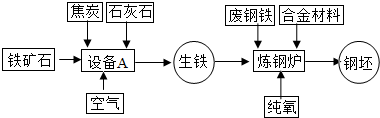 联合钢铁工业的基本生产流程示意图如下:
联合钢铁工业的基本生产流程示意图如下:
请回答下列问题:
(1)写出设备A的名称:______;
(2)写出以赤铁矿为原料在高温下与一氧化碳反应制取铁的化学方程式:
______;
(3)应用化学原理分析,工业炼钢时用纯氧而不用空气的原因是:______;
(4)铁粉与生石灰都是常用的干燥剂,现欲用化学方法检验某食品袋中的干燥剂究竟是其中的哪一种?请你简述方法和现象:______
(5))某赤铁矿石中含Fe2O380%,用3000 t这种矿石,可炼出含杂质4%的生铁质量______.
解:(1)工业炼钢在高炉中进行.
故答案为:高炉
(2)工业上用一氧化碳冶炼铁.
故答案为:3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(3)工业炼铁需要高温,燃料在纯氧中燃烧比在空气中燃烧更剧烈,放出的热量更多.
故答案为:促使反应更加剧烈,并获得更多的热量.
(4)铁与稀盐酸反应产生无色气体,但氧化钙与稀盐酸反应无明显现象.
故答案为:加入稀盐酸,有气泡产生的为铁粉,否则为生石灰.
(5)根据反应前后Fe元素守恒,设可炼出含杂质4%的生铁质量为x 则
3000×80%×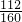 =(1-4%)x
=(1-4%)x
解得x=1750t
答:可炼出含杂质4%的生铁质量为1750t
分析:(1)(2)(3)根据高炉炼铁的原理及注意事项分析;
(4)根据铁与生石灰化学性质的不同分析;
(5)根据Fe元素守恒计算即可.
点评:在做计算题时经常用到元素守恒法,用此方法可以省去很多中间过程,从而得到简化计算过程的目的,同学们要能够灵活运用!
故答案为:高炉
(2)工业上用一氧化碳冶炼铁.
故答案为:3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2(3)工业炼铁需要高温,燃料在纯氧中燃烧比在空气中燃烧更剧烈,放出的热量更多.
故答案为:促使反应更加剧烈,并获得更多的热量.
(4)铁与稀盐酸反应产生无色气体,但氧化钙与稀盐酸反应无明显现象.
故答案为:加入稀盐酸,有气泡产生的为铁粉,否则为生石灰.
(5)根据反应前后Fe元素守恒,设可炼出含杂质4%的生铁质量为x 则
3000×80%×
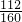 =(1-4%)x
=(1-4%)x解得x=1750t
答:可炼出含杂质4%的生铁质量为1750t
分析:(1)(2)(3)根据高炉炼铁的原理及注意事项分析;
(4)根据铁与生石灰化学性质的不同分析;
(5)根据Fe元素守恒计算即可.
点评:在做计算题时经常用到元素守恒法,用此方法可以省去很多中间过程,从而得到简化计算过程的目的,同学们要能够灵活运用!

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
某同学为了测定某铜铁混合物中铜的质量分数,先取相同质量的混合物分别置于三个等质量(100g)的烧杯中,再分别加入稀硫酸充分反应,有关实验数据如下:
| 第1杯 | 第2杯 | 第3杯 | |
| 混和物质量 | 20g | 20g | 20g |
| 稀硫酸质量 | 50g | 100g | 150g |
| 反应后烧杯及其中物质质量 | 169.8g | 219.6g | 269.6g |
(2)混合物中铜的质量分数为多少?
(3)向实验后的第三杯溶液中加入足量的铁粉,完全反应后过滤,将所得的滤液配成10%的FeSO4溶液,需要向滤液中加入多少克水?(假设实验过程中溶液损失忽略不计)
元素周期表是学习和研究化学的重要工具,如下图是元素周期表的一部分.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | 1 H 1.008 | 2 He 4.003 | ||||||
| 2 | 2 Li 6.941 | 4 Be 9.012 | 5 B 10.81 | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
| 3 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(2)表中不同种元素最本质的区别是______
A.质子数不同B.中子数不同C.相对原子质量不同D.电子数不同
(3)利用元素周期表,人们对元素的认识进入全新的飞跃时期.近日,俄罗斯科学家宣布他们将人工合成第118号元素,则此元素的核电荷数为______.