题目内容
【题目】空气、水是我们赖以生存的重要资源。
(1)Cu能与空气中的H2O、O2和_____反应生成“铜锈”[主要成分为Cu2(OH)2CO3]
(2)用_________可以区分硬水和软水,生活中常用_____方法降低水的硬度。
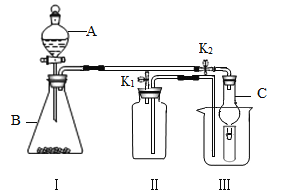
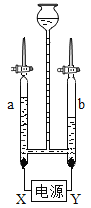
(3)电解水可制氢气。通电一段时间后,如图所示。电极X为电源的_________极,a管中的气体可用____________________来检验。
【答案】CO2 肥皂水 煮沸 正 带火星的木条
【解析】
(1)化学反应前后,元素的种类不变,据此分析;
(3)根据电解水“正氧负氢、氢二氧一”的结论进行分析,并根据氧气具有助燃的性质分析其检验方法。
(1)由Cu2(OH)2CO3可知该物质是由Cu、O、H、C四种元素组成的,根据质量守恒定律可知,该反应的反应物中一定含有这四种元素,由此可知“铜锈”是由Cu与空气中的H2O、O2和CO2反应生成的;
(2)用肥皂水可以区分硬水和软水,因为加入肥皂水后,硬水产生的浮渣多,泡沫少,软水产生的浮渣少,泡沫多;生活中常用煮沸的方法降低水的硬度;
(3)X电极与a管相连,Y电极与b管相连,b管液面较低,则b管产生的气体的体积大,所以b管产生的是氢气,a管产生的是氧气,因此电极X为电源正极;氧气能够使带火星的木条复燃,因此可以用带火星的木条检验a管中的气体。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
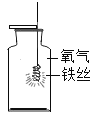
课时掌控随堂练习系列答案【题目】做完“铁在氧气里燃烧”实验后,小明同学有两个疑惑不解的问题,于是他进行了以下探究活动,请你一同参与.
(问题)铁燃烧时溅落下来的黑色物质中还有没有铁呢?
(查阅资料)(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3)
(2)铁的氧化物均能溶于酸的溶液.
(实验探究)将冷却后的黑色物质碾碎,装入试管,加入 ______ 溶液,观察到的现象是 ______,说明铁燃烧时溅落下来的黑色物质中还含有铁.
(问题)铁燃烧的产物为什么不是 Fe2O3呢?
(查阅资料)
(1)Fe3O4和Fe2O3分解温度、铁的熔点见表:
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 |
|
熔点/℃ |
|
| 1535 |
(2)Fe2O3高温时分解成Fe3O4
(理论探讨)根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在 ______ 之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
(拓展研究)
(1)实验中为了防止集气瓶炸裂,必须 ______.
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式 ______.
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色______,就说明包装盒破损进气,这样售货员就能及时发现并处理.