题目内容
【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,把60g某浓度的稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如下表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:
(1)m的数值________。
(2)60g该硫酸溶液的溶质质量分数是_______?(写出计算过程,计算结果保留1位小数)
【答案】0.04 9.8%
【解析】
(1)分析表格数据,每次加入的稀硫酸质量相同,第三次加入稀硫酸还有气体产生,说明第二次加入的稀硫酸已完全反应完,产生气体应该与第一次产生的气体一样多,故m的数值为0.04。
(2)解:设20g该硫酸溶液的溶质质量为X。
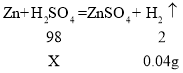
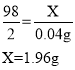
则该硫酸溶液的溶质质量分数为![]()
答:该硫酸溶液的溶质质量分数为9.8%。

练习册系列答案
相关题目