题目内容
(2009?六合区一模)在理解概念的基础上,理清概念之间的相互关系,构建知识网络是化学学习中的一种重要方法.下图是初中常见化学概念之间的相互关系.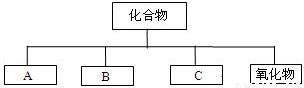
(一)请你写出B、C所属物质的类别,并以Na、H、O、S元素组成的物质为例,各写出一种代表物质的化学式,填在下表相应的空格里.
| \ | A | B | C | \ |
| 物质类别 | 酸 | 氧化物 | ||
| 化学式 |
化合反应:;
复分解反应:.
(三)下表列出了部分人体中含量较多元素的原子结构示意图.请回答下列问题:
| H | O | Na | Mg | Cl | K | Ca |
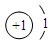 | 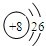 | 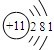 | 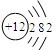 | 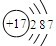 |  | 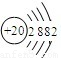 |
(2)原子的核外电子排布,特别是最外层的电子数目,与元素的化学性质有密切关系.

①;②;③.
【答案】分析:(一)根据物质分数的知识,完成对化合物又分为酸、碱、盐、氧化物的分类,并使用所提供的元素,根据四类化合物的组成特点,各写一种物质的化学式;
(二)根据化合反应与复分解反应的特点,利用所给元素所能组成的物质,写出符合反应特点的反应的化学方程式;
(三)(1)根据元素的相对原子质量近似等于质子数与中子数之和,由相对原子质量和质子数计算原子的中子数;
(2)根据镁原子的原子结构示意图,判断原子核外电子数,利用最外层电子数的特点,判断镁原子在反应是得失电子情况,最后根据镁原子与氯原子结构示意图,利用化合物中得失电子总数相等,判断两元素所形成化合物的化学式.
解答:解:(一)根据化合物中各物质的组成特点,又可把化合物分为酸、碱、盐和氧化物四类;其中酸类物质通常由氢与酸根化合成而成的物质,如H、S、O三种元素可组成H2SO4或H2SO3或H2S;碱类物质由金属和氢氧根化合而成,如Na、O、H三种元素组成的NaOH;盐类物质一般由金属与酸根化合而成,如Na、S、O三种元素组成的Na2SO4或Na2SO3或Na2S;氧化物则为两种元素且含氧元素的化合物,如Na、H、S、O四种元素可组成Na2O或H2O或SO2或SO3等;
(二)由两种或两种以上物质生成一种物质的反应称为化合反应,如S在O2中燃烧生成二氧化硫,其反应的化学方程式为S+O2 SO2;或H2在O2中燃烧生成H2O、或SO2与H2O反应生成H2SO3、与O2反应生成SO3、或SO3与H2O生成H2SO4;等等;
SO2;或H2在O2中燃烧生成H2O、或SO2与H2O反应生成H2SO3、与O2反应生成SO3、或SO3与H2O生成H2SO4;等等;
两种化合物交换成分生成另外两种化合物的反应称为复分解反应;如硫酸与氢氧化钠反应生成硫酸钠和水H2SO4+2NaOH═Na2SO4+2H2O;
(三)(1)根据钙原子的原子结构示意图,钙原子核内有20个质量,则它的中子数=40-20=20;
(2)根据镁原子的原子结构示意,镁原子核外有12个电子;镁原子最外层有2个电子,小于4,在反应中表现出易失电子;而氯原子最外层有7个电子,易得1个电子,在与镁元素化合时,根据化合物中得失电子总数相等,每个镁原子应与2个氯原子结合,所形成物质的化学式为MgCl2;
故答案为:
(一)
(二)S+O2 SO2(或2H2+O2
SO2(或2H2+O2 2H2O); H2SO4+2NaOH═Na2SO4+2H2O;
2H2O); H2SO4+2NaOH═Na2SO4+2H2O;
(三)(1)20;(2)①12;②失;③MgCl2.
点评:根据元素的原子结构示意图,最外层电子数小于4时,化学变化中易失去电子;最外层电子数大于4时,化学变化中易得到电子.
(二)根据化合反应与复分解反应的特点,利用所给元素所能组成的物质,写出符合反应特点的反应的化学方程式;
(三)(1)根据元素的相对原子质量近似等于质子数与中子数之和,由相对原子质量和质子数计算原子的中子数;
(2)根据镁原子的原子结构示意图,判断原子核外电子数,利用最外层电子数的特点,判断镁原子在反应是得失电子情况,最后根据镁原子与氯原子结构示意图,利用化合物中得失电子总数相等,判断两元素所形成化合物的化学式.
解答:解:(一)根据化合物中各物质的组成特点,又可把化合物分为酸、碱、盐和氧化物四类;其中酸类物质通常由氢与酸根化合成而成的物质,如H、S、O三种元素可组成H2SO4或H2SO3或H2S;碱类物质由金属和氢氧根化合而成,如Na、O、H三种元素组成的NaOH;盐类物质一般由金属与酸根化合而成,如Na、S、O三种元素组成的Na2SO4或Na2SO3或Na2S;氧化物则为两种元素且含氧元素的化合物,如Na、H、S、O四种元素可组成Na2O或H2O或SO2或SO3等;
(二)由两种或两种以上物质生成一种物质的反应称为化合反应,如S在O2中燃烧生成二氧化硫,其反应的化学方程式为S+O2
 SO2;或H2在O2中燃烧生成H2O、或SO2与H2O反应生成H2SO3、与O2反应生成SO3、或SO3与H2O生成H2SO4;等等;
SO2;或H2在O2中燃烧生成H2O、或SO2与H2O反应生成H2SO3、与O2反应生成SO3、或SO3与H2O生成H2SO4;等等;两种化合物交换成分生成另外两种化合物的反应称为复分解反应;如硫酸与氢氧化钠反应生成硫酸钠和水H2SO4+2NaOH═Na2SO4+2H2O;
(三)(1)根据钙原子的原子结构示意图,钙原子核内有20个质量,则它的中子数=40-20=20;
(2)根据镁原子的原子结构示意,镁原子核外有12个电子;镁原子最外层有2个电子,小于4,在反应中表现出易失电子;而氯原子最外层有7个电子,易得1个电子,在与镁元素化合时,根据化合物中得失电子总数相等,每个镁原子应与2个氯原子结合,所形成物质的化学式为MgCl2;
故答案为:
(一)
| \ | A | B | C | \ |
| 物质类别 | 碱 | 盐 | ||
| 化学式 | H2SO4 | NaOH | Na2SO4 | H2O(或SO2、SO3、Na2O) |
 SO2(或2H2+O2
SO2(或2H2+O2 2H2O); H2SO4+2NaOH═Na2SO4+2H2O;
2H2O); H2SO4+2NaOH═Na2SO4+2H2O;(三)(1)20;(2)①12;②失;③MgCl2.
点评:根据元素的原子结构示意图,最外层电子数小于4时,化学变化中易失去电子;最外层电子数大于4时,化学变化中易得到电子.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目



