题目内容
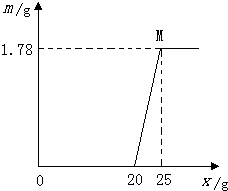 (2009?荆州)某工业盐酸因含Fe3+而呈黄色(不再含其他杂质),为了测定其组成含量,取这种工业盐酸20g,向其中加溶质质量分数为40%的NaOH溶液,其生成Fe(OH)3,沉淀的质量(m)与滴加NaOH溶液的质量(x)的关系如图所示.
(2009?荆州)某工业盐酸因含Fe3+而呈黄色(不再含其他杂质),为了测定其组成含量,取这种工业盐酸20g,向其中加溶质质量分数为40%的NaOH溶液,其生成Fe(OH)3,沉淀的质量(m)与滴加NaOH溶液的质量(x)的关系如图所示.(1)若所取的这种工业盐酸中Cl-的个数为n1,H+的个数为n2,Fe3+的个数为n3,请写出n1,n2,n3之间存在的等式关系:
n1=n2+3n3
n1=n2+3n3
(2)写出滴加NaOH溶液的过程中先后发生反应的化学方程式:
NaOH+HCl═NaCl+H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl
NaOH+HCl═NaCl+H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl
(3)M点对应的溶液质量为
43.22
43.22
g(保留二位小数),其中所含的溶质是NaCl
NaCl
.(4)求这种工业盐酸中HCl的质量分数. (保留一位小数)
分析:(1)根据在溶液中正负电荷的代数和为零来分析;
(2)根据方程式的书写方法考虑;
(3)根据溶液质量的计算方法,溶质要根据反应后的生成物考虑;
(4)根据氢氧化钠与盐酸反应时消耗的氢氧化钠的质量来计算氯化氢的质量,再除以20g即可.
(2)根据方程式的书写方法考虑;
(3)根据溶液质量的计算方法,溶质要根据反应后的生成物考虑;
(4)根据氢氧化钠与盐酸反应时消耗的氢氧化钠的质量来计算氯化氢的质量,再除以20g即可.
解答:解:(1)在溶液中正负电荷的代数和为零,由于一个H+带一个单位的正电荷,H+的个数为n2则带了n2个正电荷,由于一个Fe3+ 带3个单位的负电荷,所以Fe3+的个数为
n3 所以带了3n3个正电荷,所以正电荷总数为n2+3n3个正电荷;由于一个Cl- 带一个单位的负电荷,Cl-的个数为n1带负电荷数为n1个;所以n1=n2+3n3;
(2)滴加氢氧化钠时,氢氧化钠先与盐酸反应,把盐酸反应掉后,又与氯化铁反应,氢氧化钠与盐酸反应的反应物是氢氧化钠与盐酸,生成物是氯化钠和水,已经平了;氢氧化钠与氯化铁反应的反应物是氢氧化钠和氯化铁,生成物是氢氧化铁沉淀和氯化钠,先配平氢氧根离子,再用观察法配平其它元素即可;
(3)溶液的质量=20g+25g-1.78g=43.22g,根据两个反应的生成物分别是氯化钠、水、氢氧化铁、氯化钠,又因为氢氧化铁是沉淀,所以溶质是氯化钠;
(4)设与氢氧化钠反应消耗氯化氢的质量为x则:
NaOH+HCl═NaCl+H2O
40 36.5
20g×40% x
根据:
=
解得:x=7.3g;
则这种工业盐酸中HCl的质量分数:
×100%=36.5%.
故答案为:
(1)n1=n2+3n3;
(2)NaOH+HCl═NaCl+H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl;
(3)43.22g;NaCl;
(4)36.5%.
n3 所以带了3n3个正电荷,所以正电荷总数为n2+3n3个正电荷;由于一个Cl- 带一个单位的负电荷,Cl-的个数为n1带负电荷数为n1个;所以n1=n2+3n3;
(2)滴加氢氧化钠时,氢氧化钠先与盐酸反应,把盐酸反应掉后,又与氯化铁反应,氢氧化钠与盐酸反应的反应物是氢氧化钠与盐酸,生成物是氯化钠和水,已经平了;氢氧化钠与氯化铁反应的反应物是氢氧化钠和氯化铁,生成物是氢氧化铁沉淀和氯化钠,先配平氢氧根离子,再用观察法配平其它元素即可;
(3)溶液的质量=20g+25g-1.78g=43.22g,根据两个反应的生成物分别是氯化钠、水、氢氧化铁、氯化钠,又因为氢氧化铁是沉淀,所以溶质是氯化钠;
(4)设与氢氧化钠反应消耗氯化氢的质量为x则:
NaOH+HCl═NaCl+H2O
40 36.5
20g×40% x
根据:
| 40 |
| 36.5 |
| 20g×40% |
| x |
则这种工业盐酸中HCl的质量分数:
| 7.3g |
| 20g |
故答案为:
(1)n1=n2+3n3;
(2)NaOH+HCl═NaCl+H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl;
(3)43.22g;NaCl;
(4)36.5%.
点评:要能读懂这个图表示的意义,前20g氢氧化钠溶液是与盐酸反应,后5g氢氧化钠溶液是与氯化铁反应,再根据题意进行进一步计算.

练习册系列答案
相关题目
 ,请根据下列几种情况回答问题.
,请根据下列几种情况回答问题.