题目内容
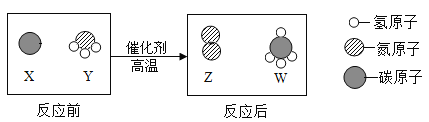
【题目】学习化学要树立可持续发展的意识,明确资源合理开发的重要性。自然界中的两种物质经过一系列反应就会制得碱E,不信?看看下面这个流程,已知F是贝壳的主要成分。(说明:用“一”表示两物质能发生反应,用“→”表示一种物质能转化为另一种物质,假设贝壳和草木灰中的杂质均不影响下列反应)

(1)写出下列物质的化学式:草木灰的主要成分是_________ F.__________
(2)A和B发生反应的化学方程式为__________________________________________;
(3)将清液C和清液D混合后,会观察到的现象为______________________________;
(4)该流程中,对环境保护不利的一个步骤是步骤_______(填序号),在实际生产过程中,还有必要加以优化。
【答案】 K2CO3 CaCO3 CaO+H2O===Ca(OH)2 (清液中)产生白色沉淀 ②
【解析】(1) 草木灰的主要成分是K2CO3,F是CaCO3;(2) 贝壳高温煅烧后生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,故A为氧化钙,B为水,又因为F是贝壳的主要成分,故F为碳酸钙,氢氧化钙和碳酸钾反应生成碳酸钙和氢氧化钾,故C为氢氧化钙,E为氢氧化钾,带入验证,推导正确,故A和B发生反应的化学方程式为:CaO+H2O===Ca(OH)2;(3)将清液C和清液D混合后,氢氧化钙和碳酸钾反应生成碳酸钙和氢氧化钾,所以会观察到的现象为(清液中)产生白色沉淀;(4)该流程中,对环境保护不利的一个步骤是步骤是②,因为燃烧秸秆会产生二氧化硫等大气污染物,在实际生产过程中,还有必要加以优化。

 名校课堂系列答案
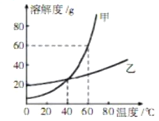
名校课堂系列答案【题目】KCl和KNO3的溶解度表及溶解度曲线如下图所示,下列说法不正确的是 ( )
温度/℃ | 20 | 30 | 40 | 50 | |
溶解度S/g | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
A. 甲表示KCl溶解度曲线 
B. 温度t1应在20℃~30℃之间
C. 40℃时,5gKCl加入10g水中,可得到33.3%的溶液
D. 50℃时,30g KNO3加入50g水,充分溶解,再降温到30℃,有晶体析出