题目内容
【题目】下图分别是甲、乙两个实验小组,分别进行“加热硫酸铜和氢氧化钠两种溶液反应后的混合物”的实验过程及实验现象的示意图: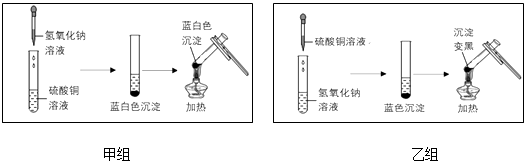
(1)【甲组】氢氧化钠与硫酸铜反应的化学方程式为 , 加热两种溶液反应后的混合物,生成的黑色物质是氧化铜。
(2)【乙组】为寻找两种溶液反应后的混合物在加热后没有产生氧化铜的原因,他们进行了以下实验探究:
【查阅资料】
a.氢氧化铜受热分解生成氧化铜和水。
b.在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:
6NaOH+4CuSO4=3Na2SO4+Cu4(OH)6SO4↓,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
【提出猜想】根据资料分析,乙组同学认为本组实验中氢氧化钠溶液不足,导致试管中溶液偏酸性的原因可能是:
猜想Ⅰ:过量的硫酸铜导致溶液呈酸性 猜想Ⅱ:生成的硫酸钠使溶液呈酸性。
【实验与结论】
实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH7(填“>”、“<”或“=”),硫酸铜溶液呈酸性,猜想Ⅰ成立。
实验②:向盛有硫酸钠溶液的试管中滴加石蕊溶液,观察到溶液仍显紫色,硫酸钠溶液呈(填“酸性”、“中性”或“碱性”),猜想Ⅱ不成立。
(3)【交流与反思】
①乙组同学认真分析甲组实验后,认为不需要通过实验也能判定猜想Ⅱ不成立,理由是。
②甲、乙两组实验说明相同的反应物会因其质量比的不同而可能导致不同。
【答案】
(1)CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
(2)PH<7,中性
(3)甲组实验中也生成了Na2SO4,若它显酸性,在此条件下CuSO4和NaOH也会生成蓝白色沉淀,(或若 Na2SO4显酸性,甲组实验中不可能生成蓝色沉淀Cu(OH)2,因为Cu(OH)2与酸性溶液会反应) 生成物不同(或实验现象不同)
【解析】【甲组】氢氧化钠与硫酸铜反应的化学方程式为 2NaOH+CuSO4= Na2SO4+ Cu(OH)2↓;
【实验与结论】实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH ﹤7(填“﹥”、“﹤”或“﹦”),硫酸铜溶液呈酸性,猜想Ⅰ成立。实验②:向盛有硫酸钠溶液的试管中逐滴加石蕊溶液,观察到溶液显紫色,硫酸钠溶液呈 中性(填“酸”、“中”或“碱”),猜想Ⅱ不成立。【交流和反思】①乙组同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想Ⅱ不成立,理由是甲组实验中也生成了Na2SO4,若它显酸性,在此条件下CuSO4和NaOH也会生成蓝白色沉淀(或若 Na2SO4显酸性,甲组实验中不可能生成蓝色沉淀Cu(OH)2,因为Cu(OH)2与酸性溶液会反应);②在化学反应中,相同的反应物因质量比不同可能会导致生成物不同(或实验现象不同)。
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.

