题目内容
【题目】汉代海昏侯墓出土的文物中,保存完好的玉器非常罕见。玉石主要成分NaAlSi2O6,下列对NaAlSi2O6的描述正确的是
A. 含有3个氧分子
B. 相对分子质量为94
C. Na与Al的质量比为23:27
D. Na元素的质量分数为13.4%
【答案】C
【解析】A. 分子由原子构成,化学式中元素符号右下角的数字为一个分子中原子个数,所以一个NaAlSi2O6中含有6个氧原子;B. 相对分子质量=(相对原子质量×原子个数)之和,NaAlSi2O6的 相对分子质量为23+27+28×2+16×6=202;C. 化合物中元素的质量比=(相对原子质量×原子个数)之比,Na与Al的质量比为23:27;D. ![]() , Na元素的质量分数为23÷202≈11.4%.选C
, Na元素的质量分数为23÷202≈11.4%.选C

【题目】某研究小组对自动充气气球(如图1)进行下列探究。

【查阅资料】
①该气球的充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
②氯化钙水溶液呈中性,碳酸钠、碳酸氢钠的水溶液均呈碱性。
③用一定溶质质量分数的NaHCO3和Na2CO3溶液进行实验,实验现象记录如下:
NaHCO3溶液 | Na2CO3溶液 | |
加入澄清石灰水 | 溶液变浑浊 | 溶液变浑浊 |
加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 |
加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 |
探究1:液体包内溶液的酸碱性
室温时,用pH试纸测得溶液的pH=3,则该溶液呈________性。
探究2:白色粉末的成分
【猜想与假设】甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠;丁同学认为是碳酸钠和碳酸氢钠的混合物。
【进行实验】
(1)将少量白色粉末放入水中搅拌,观察到____________,说明甲同学的猜想不正确。
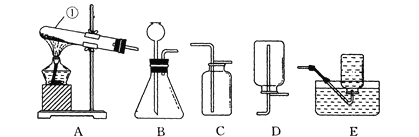
(2)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%的盐酸(装置如图2),记录如下表:

实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
Ⅰ | 碳酸氢钠 | 0.10 | V1 |
Ⅱ | 碳酸钠 | 0.10 | V2 |
Ⅲ | 白色粉末 | a | V1 |
【解释与结论】
(1)实验Ⅰ的化学方程式为_________________________。
(2)表中a=________;V1______V2(填“>”、“<”或“=”)。
(3)上述实验得出的结论及判断依据是___________________________。
【反思与评价】
老师指出还可以采用更简单的方法得出与上述实验(2)相同的结论,实验方案为_________。