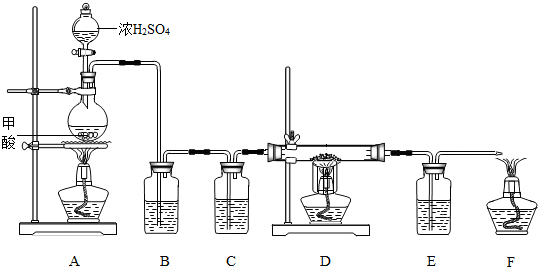
题目内容
氧化铜和铜的混合物2g,用氢气完全还原后铜粉的质量为1.8g,求原混合物中铜的质量分数是多少?
解:设原混合物中含氧化铜的质量为x,
CuO+H2 Cu+H2O 固体质量减少
Cu+H2O 固体质量减少
80 64 80-64=16
x 2g-1.8g=0.2g

x=1g
则原混合物中含铜的质量分数为: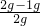 g×100%=50%.
g×100%=50%.
答:原混合物中铜的质量分数是50%
分析:用差量法解答本题.由氢气还原氧化铜的化学方程式CuO+H2 Cu+H2O可以看出,原混合物的质量与还原后共得到铜的质量之差,就是固体减少的质量,据此列出比例式,就可计算出混合物中含氧化铜的质量,然后根据质量分数公式计算出原混合物中含铜的质量分数.
Cu+H2O可以看出,原混合物的质量与还原后共得到铜的质量之差,就是固体减少的质量,据此列出比例式,就可计算出混合物中含氧化铜的质量,然后根据质量分数公式计算出原混合物中含铜的质量分数.
点评:本题主要考查学生利用差量法和化学方程式解答问题的能力.利用差量法解答有关化学方程式的计算问题,是较常见的一种解题方法,关键是分析清楚差量与物质质量的关系.
CuO+H2
 Cu+H2O 固体质量减少
Cu+H2O 固体质量减少80 64 80-64=16
x 2g-1.8g=0.2g

x=1g
则原混合物中含铜的质量分数为:
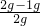 g×100%=50%.
g×100%=50%.答:原混合物中铜的质量分数是50%
分析:用差量法解答本题.由氢气还原氧化铜的化学方程式CuO+H2
 Cu+H2O可以看出,原混合物的质量与还原后共得到铜的质量之差,就是固体减少的质量,据此列出比例式,就可计算出混合物中含氧化铜的质量,然后根据质量分数公式计算出原混合物中含铜的质量分数.
Cu+H2O可以看出,原混合物的质量与还原后共得到铜的质量之差,就是固体减少的质量,据此列出比例式,就可计算出混合物中含氧化铜的质量,然后根据质量分数公式计算出原混合物中含铜的质量分数.点评:本题主要考查学生利用差量法和化学方程式解答问题的能力.利用差量法解答有关化学方程式的计算问题,是较常见的一种解题方法,关键是分析清楚差量与物质质量的关系.

练习册系列答案
相关题目
在实验室开放日,老师给某化学兴趣的同学一包氧化铜和铜的混合物样品.要求该兴趣小组的同学测定样品中氧化铜的质量分数.同学们称取5克样品放于烧杯中,再把20克稀硫酸平均分四次加入烧杯中并搅拌,上期充分反应.有关实验数据如下表:
计算:(1)样品中氧化铜的质量分数.
(2)所用稀硫酸中溶质的质量分数.
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 5 | 5 | 5 | 5 |
| 烧杯中剩余固体的质量/g | 4.2 | 3.4 | 3.0 | 3.0 |
(2)所用稀硫酸中溶质的质量分数.
现有氧化铜和铜的混合物,对其成分进行分析.取10g此样品,向其中分六次加入相同溶质质量分数的稀硫酸,使其充分反应.每次所用稀硫酸的质量及其剩余固体的质量记录如表:
试回答下列问题:
(1)上述表格中m 值为 ,10g 样品中CuO的质量为 g.
(2)计算所加稀硫酸中溶质的质量分数.(精确到0.1%)
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
| 加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
| 充分反应后剩余固体的质量/g | 8 | 6 | 4 | 3 | 3 | m |
(1)上述表格中m 值为
(2)计算所加稀硫酸中溶质的质量分数.(精确到0.1%)
现有氧化铜和铜的混合物,对其成分进行分析.取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:(反应的化学方程式:CuO+H2SO4═CuSO4+H2O)
试回答下列问题:
(1)上述表格中m的值为 ,10g样品中CuO的质量为 g.
(2)计算所加入稀硫酸中溶质的质量分数?
(3)计算第三次加稀硫酸反应后所得溶液中溶质的质量分数?(精确到0.1%)
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 充分反应后剩余固体质量/g | 8 | 6 | 4 | 3 | m |
(1)上述表格中m的值为
(2)计算所加入稀硫酸中溶质的质量分数?
(3)计算第三次加稀硫酸反应后所得溶液中溶质的质量分数?(精确到0.1%)