题目内容
【题目】一般情况下,金属越活泼,与酸反应的速度越快。为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验。
(实验步骤)
①取ABC三支试管,分别加入2mL浓度相同的盐酸溶液,
②分别加入足量的、大小相等的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上。
(实验预测与分析)
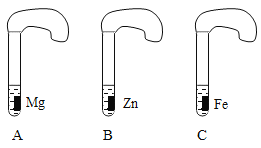
(1)写出铁与盐酸反应的化学方程式:_____________.
(2)气球膨胀速度最快的是___(填试管编号),根据实验现象,你能得出这三种金属的活动性顺序为_______。
(3)若用金属与化合物(盐)溶液的反应来比较Mg、Zn、Fe三种金属的活动性顺序,现已有Mg和Fe,还需用到的一种化合物(盐)溶液为________溶液。
【答案】Fe + 2HCl = FeCl2 + H2↑ A Mg、Zn、Fe 硫酸锌
【解析】
(1)铁与盐酸反应产生氯化亚铁和氢气的化学方程式:Fe + 2HCl = FeCl2 + H2↑;
(2)镁的金属活泼性最强,产生氢气速率最快,气球膨胀速度最快的是A,试管C中气球膨胀的速率最慢,根据实验现象,得出这三种金属的活动性顺序为:Mg>Zn>Fe;
(3)若用金属与化合物(盐)溶液的反应来比较Mg、Zn、Fe三种金属的活动性顺序,现已有Mg和Fe,还需用到的一种化合物(盐)溶液为硫酸锌溶液;先将铁放入硫酸锌溶液,无明显现象,说明金属活动顺序:锌>铁;然后将镁放入硝酸锌溶液中,固体表面有银白色物质析出,说明金属活动顺序:镁>锌,整理可知:Mg>Zn>Fe。

练习册系列答案
相关题目