题目内容
(2009?福建)某学习小组进行化学实验:向20.0g某铜锌合金样品中,依次加入等量稀硫酸,并测得每次生成氢气的质量.有关实验数据记录如表:
(1)分析判断第3次实验生成氢气的质量m的数值为
(2)计算该铜锌合金中锌的质量分数(根据化学方程式计算).
| 实 验 次 序 | 第1次 | 第2次 | 第3次 |
| 加入稀硫酸的质量/g | 100.0 | 100.0 | 100.0 |
| 生成氢气的质量/g | 0.3 | 0.1 | m |
0
0
.(2)计算该铜锌合金中锌的质量分数(根据化学方程式计算).
分析:(1)根据加入硫酸与生成氢气的关系分析,通过1、2次比较可知第一次硫酸全部参加了反应,第二次硫酸没有全部参加反应,再进一步分析第3次生成氢气的情况;
(2)由题意可知共生成0.4g氢气,根据氢气的质量算出锌的质量,再用锌的质量除以20g乘以百分之百即可.
(2)由题意可知共生成0.4g氢气,根据氢气的质量算出锌的质量,再用锌的质量除以20g乘以百分之百即可.
解答:解:(1)通过1、2次比较可知第一次硫酸全部参加了反应,即100g稀硫酸完全反应只能生成0.3g氢气,第二次加入100g生成0.1g,说明硫酸没有全部参加反应即锌全部反应完了,所以第3次不能产生氢气,即m=0;
(2)由题意可知共生成0.4g氢气,设要生成0.4g氢气需要参加反应的锌的质量为X则:
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
根据:
=
解得x=13g,
所以铜锌合金中锌的质量分数:
×100%=65%.
故答案为:(1)0;(2)65%.
(2)由题意可知共生成0.4g氢气,设要生成0.4g氢气需要参加反应的锌的质量为X则:
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
根据:
| 65 |
| 2 |
| x |
| 0.4g |
解得x=13g,
所以铜锌合金中锌的质量分数:
| 13g |
| 20g |
故答案为:(1)0;(2)65%.
点评:解答本题的关键是通过分析加入硫酸的质量相同,生成氢气的质量不同的原因来解.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
(2009?崇文区二模)请将五氧化二磷的化学式填在下表中相应的位置,并根据下表回答有关问题:[除(3)外,各小题均用序号填空]
(1)表中的物质属于单质的是,属于有机物的是.
(2)表中的物质可用于人工降雨的是,可用于制肥皂、造纸等工业的碱是.
(3)写出甲烷燃烧的化学方程式.
(4)若要测定某烧碱溶液的酸碱度,不能选用下列选项中的.①无色酚酞溶液;②紫色石蕊溶液;③pH试纸
(5)我国福建生产一种槟榔芋,芋皮上含有一种碱性的物质--皂角素,皮肤沾上它会奇痒难忍.你认为可选用下列中的来涂抹止痒.
①食醋;②熟石灰;③肥皂水;④柠檬汁.
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 物质名称 | 甲烷 | 氧气 | 烧碱 | 干冰 | 五氧化二磷 |
| 化学式 | CH4 | O2 | NaOH | CO2 | 【P2O5】 |
(2)表中的物质可用于人工降雨的是,可用于制肥皂、造纸等工业的碱是.
(3)写出甲烷燃烧的化学方程式.
(4)若要测定某烧碱溶液的酸碱度,不能选用下列选项中的.①无色酚酞溶液;②紫色石蕊溶液;③pH试纸
(5)我国福建生产一种槟榔芋,芋皮上含有一种碱性的物质--皂角素,皮肤沾上它会奇痒难忍.你认为可选用下列中的来涂抹止痒.
①食醋;②熟石灰;③肥皂水;④柠檬汁.
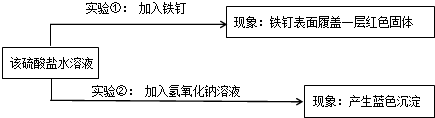
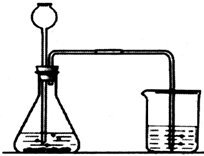 (2009?福建)某化学兴趣小组到光明石灰厂进行综合实践活动,他们了解到:该厂产品生石灰(CaO)是用石灰石经高温煅烧得到的.为了探究该厂生产的生石灰中是否含有未烧透的石灰石,他们取回产品样品进行如图实验.
(2009?福建)某化学兴趣小组到光明石灰厂进行综合实践活动,他们了解到:该厂产品生石灰(CaO)是用石灰石经高温煅烧得到的.为了探究该厂生产的生石灰中是否含有未烧透的石灰石,他们取回产品样品进行如图实验.