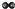题目内容
 将质量相等的A、B两块金属,分别放入溶质质量分数相等的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系如图所示(产物中A、B两种元素的化合价相同).分析如图,可以获得的正确信息有( )
将质量相等的A、B两块金属,分别放入溶质质量分数相等的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系如图所示(产物中A、B两种元素的化合价相同).分析如图,可以获得的正确信息有( )| A、金属活动性顺序A>B |
| B、放出H2的质量是A>B |
| C、反应速率是A>B |
| D、相对原子质量是A>B |
考点:金属的化学性质
专题:金属与金属材料
分析:在金属活动性顺序中,金属的位置越靠前,与酸反应的速度越快,在坐标中斜线越陡;当与酸反应生成的盐中金属的化合价相同时,生成氢气的质量与相对原子质量有关,相对原子质量越大,生成的氢气越少.
解答:解:
A、根据坐标图可以看出,B在t1时已经反应完毕,而A在t2时反应结束,t1<t2,所以B反应的快,使用的时间少,则金属活动性顺序B>A,故A错误;
B、金属与酸反应生成的盐中金属的化合价A和B的相同,相对原子质量越大,生成的氢气越少,根据坐标可以看出,A生成的氢气质量大于B生成的氢气质量,故B正确;
C、在坐标图中,t1<t2,所以B反应的快,使用的时间少,则反应速率是B>A,故C错误;
D、金属与酸反应生成的盐中金属的化合价A和B的相同,相对原子质量越大,生成的氢气越少,根据坐标可以看出,A生成的氢气质量大于B生成的氢气质量,故A的相对原子量小于B的相对原子质量,故D错误;
故选:B.
A、根据坐标图可以看出,B在t1时已经反应完毕,而A在t2时反应结束,t1<t2,所以B反应的快,使用的时间少,则金属活动性顺序B>A,故A错误;
B、金属与酸反应生成的盐中金属的化合价A和B的相同,相对原子质量越大,生成的氢气越少,根据坐标可以看出,A生成的氢气质量大于B生成的氢气质量,故B正确;
C、在坐标图中,t1<t2,所以B反应的快,使用的时间少,则反应速率是B>A,故C错误;
D、金属与酸反应生成的盐中金属的化合价A和B的相同,相对原子质量越大,生成的氢气越少,根据坐标可以看出,A生成的氢气质量大于B生成的氢气质量,故A的相对原子量小于B的相对原子质量,故D错误;
故选:B.
点评:本题考查了金属与酸反应的速率和生成氢气的质量关系,完成此题,可以依据已有的知识进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
小唐同学用98%的浓硫酸配制一定质量的10%的稀硫酸,在用量筒量取浓硫酸时,不恰当地俯视了读数.其他步骤均正确.他配制的稀硫酸的溶质质量分数( )
| A、偏高 | B、偏低 |
| C、准确 | D、都有可能 |
生活中处处有化学,以下做法不合理的是( )
| A、室内起火时,不要急于打开所有门窗 |
| B、火灾中所处烟雾较浓时,应用湿毛巾捂住口鼻,并尽量贴近地面逃离 |
| C、将燃气热水器安装在浴室里 |
| D、用加热煮沸的方法来降低水的硬度 |
在Na2S、Na2SO3、Na2SO4的混合物中,测得氧元素的质量分数为22%,则混合物中钠元素的质量分数为( )
| A、39.9% | B、46% |
| C、23% | D、78% |
在H2、H2O、Ca(OH)2、H2SO4四种物质中共同含有( )
| A、两个氢原子 | B、氢元素 |
| C、两个氢元素 | D、一个氢分子 |
某学生用量筒量液时,仰视读数为13.2mL,则他实际量取液体体积是( )
| A、等于13.2mL |
| B、大于13.2mL |
| C、小于13.2mL |
| D、以上三种都不对 |
熄灭酒精灯时( )
| A、用嘴吹灭 |
| B、用灯帽盖灭 |
| C、用扇子扇灭 |
| D、以上三种方法都可以 |
用下列几组物质对Ag、Fe、Cu三种金属活动性顺序的探究,不可行的是( )
| A、Fe、Ag、CuSO4溶液 |
| B、Cu、Ag、FeSO4溶液 |
| C、Fe、Cu、AgNO3溶液、稀盐酸 |
| D、Cu、FeSO4溶液、AgNO3溶液 |
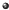 ”表示氢原子,用“
”表示氢原子,用“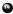 ”表示氧原子,其中能保持氢气的化学性质的粒子是( )
”表示氧原子,其中能保持氢气的化学性质的粒子是( )