题目内容
人类生活和工农业生产都离不开水,右图是自来水厂净化水的过程示意图: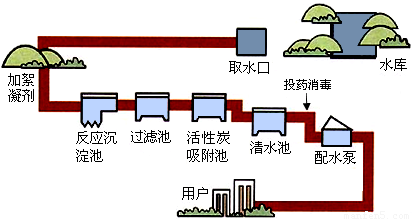
(1)自来水厂生产水时,使用的净水方法有 ;
A.沉淀 B.过滤 C.煮沸 D.蒸馏 E.吸附
(2)取水后加入絮凝剂(明矾)的作用是 ;
(3)自来水厂常用ClO2来消毒,漂白粉[有效成分为Ca(ClO)2]也可用于饮用水消毒.工业上制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2=X+Ca(ClO)2+2H2O,X的化学式为 ,反应前后Cl元素的化合价 (填字母〕
A.升高 B.降低 C.既升高又降低 D.不变.
【答案】分析:(1)根据自来水厂净化水的过程示意图,判断自来水厂生产水时,所使用的净水方法;
(2)根据对净化水的方法的认识,说明明矾在净化水中所起的作用;
(3)根据化学变化前后原子种类、数目不变,由反应的化学方程式,推断生成物X的化学组成,写出其化学式,并利用化学式计算反应前后含氯元素物质中氯元素化合价,对比反应前后氯元素化合价变化情况.
解答:解:(1)自来水厂生产水时,使用到的净水方法有:沉淀池中进行的沉淀,过滤池中进行的过滤,吸附池中进行的吸附;故为ABE;
(2)明矾具有吸附水中固体小颗粒而加快沉降性能,取水后加入絮凝剂(明矾)的作用使悬浮物沉淀;
(3)由化学方程式2Cl2+2Ca(OH)2=X+Ca(ClO)2+2H2O,可知反应前2Cl2、2Ca(OH)2中含有Cl、Ca、O、H四种元素原子的个数分别为4、2、4、4,而反应后Ca(ClO)2、2H2O中仅含Cl、Ca、O、H四种元素原子的个数分别为2、1、4、4,根据化学变化前后原子种类、数目不变,可判断生成物X的分子由2个Cl原子与1个Ca原子构成,物质X的化学式为CaCl2;反应前单质Cl2中氯元素化合价为0,而反应后CaCl2、Ca(ClO)2中氯元素化合价分别为-1、+1价,因此,反应前后Cl元素的化合价既有升高又有降低,故选C;
故答案为:
(1)ABE;
(2)使悬浮物沉淀(或使悬浮物沉降);
(3)CaCl2;C.
点评:根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.
(2)根据对净化水的方法的认识,说明明矾在净化水中所起的作用;
(3)根据化学变化前后原子种类、数目不变,由反应的化学方程式,推断生成物X的化学组成,写出其化学式,并利用化学式计算反应前后含氯元素物质中氯元素化合价,对比反应前后氯元素化合价变化情况.
解答:解:(1)自来水厂生产水时,使用到的净水方法有:沉淀池中进行的沉淀,过滤池中进行的过滤,吸附池中进行的吸附;故为ABE;
(2)明矾具有吸附水中固体小颗粒而加快沉降性能,取水后加入絮凝剂(明矾)的作用使悬浮物沉淀;
(3)由化学方程式2Cl2+2Ca(OH)2=X+Ca(ClO)2+2H2O,可知反应前2Cl2、2Ca(OH)2中含有Cl、Ca、O、H四种元素原子的个数分别为4、2、4、4,而反应后Ca(ClO)2、2H2O中仅含Cl、Ca、O、H四种元素原子的个数分别为2、1、4、4,根据化学变化前后原子种类、数目不变,可判断生成物X的分子由2个Cl原子与1个Ca原子构成,物质X的化学式为CaCl2;反应前单质Cl2中氯元素化合价为0,而反应后CaCl2、Ca(ClO)2中氯元素化合价分别为-1、+1价,因此,反应前后Cl元素的化合价既有升高又有降低,故选C;
故答案为:
(1)ABE;
(2)使悬浮物沉淀(或使悬浮物沉降);
(3)CaCl2;C.
点评:根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目