题目内容
【题目】在学习“金属的冶炼”时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克。(所含杂质不参加反应)

(1)该实验利用了一氧化碳的 性,玻璃管内观察到的现象是 。
(2)甲同学的方法:先测出氢氧化钠浓溶液的质量为50克,待反应完全后再次称量,质量为54.4克。请你计算样品中氧化铜的质量分数。(一氧化碳不与氢氧化钠溶液反应)
(3)乙同学的方法:先称量出玻璃管及样品的总质量为m1,待反应完全后再次称量,质量为m2,利用m1-m2的值,求出样品中氧化铜的质量分数。其中m1-m2的值是指 的质量。
(4)同学们查阅到CO除了具有可燃性、难溶于水等性质外,还具有毒性。因此,本实验中还需对尾气进行处理。请你提出一种处理方法 。
【答案】(1)还原性 ,黑色的固体变成红色 (2)80%
(3)氧化铜中氧元素的质量 (4)将尾气点燃或收集
【解析】
试题分析:(1)一氧化碳和氧化铜反应中,做还原剂,有还原性 (2)反应前固体氧化铜是黑色,反应后生成的铜是红色,故:黑色的固体变成红色
(2)氢氧化钠的用途是吸收生成的二氧化碳,故:生成二氧化碳的质量为:54.4g- 50g=4.4g
设样品中氧化铜的质量为x
CO + CuO △ Cu + CO2
80 44
X 4.4g
80/x=44/4.4g x=8g
样品中氧化铜的质量分数:8g÷10g×100%=80%
(3)m1是氧化铜和杂质的总质量,m2是铜和杂质的总质量,所以m1-m2的值是指氧化铜中氧元素的质量。
(4)根据一氧化碳有可燃性,可以将一氧化碳收集;也可以用排水法或大气囊收集起来。

【题目】氢氧化钠和氢氧化钙是两种常见的碱。李红同学将两种碱的溶液分别装人试管A 、B 中,并进行了如下图所示的三组实验。
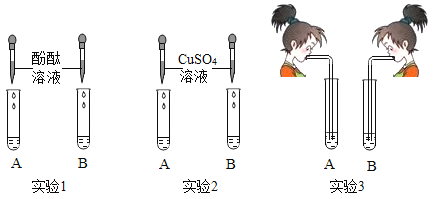
(1)实验l 中,两支试管的溶液都变成___________色。
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为______________,该反应的墓本类型是_______________反应。
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式为_______________________。B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究。
提出猜想:
猜想1 :溶质只有氢氧化钠
猜想2 :溶质只有碳酸钠
猜想3 :溶质有氢氧化钠和碳酸钠
……
实验和结论:
实验 | 实验现象 | 结论 |
取B 中少量溶液,加人澄清石灰水至不再产生沉淀为止,过滤后取上层清液,向其中加几滴酚酞试液。 | 产生白色沉淀溶液呈现红色 | 猜想3成立 |
反思与评价:
老师评价李红得出的结论不正确,是因为猜想___________________(填数字)也会产生相同的现象。如果要验证“猜想3成立”,必须要换试剂,将______溶液换成________溶液。