题目内容
下面是某学习小组,在探究金属活动性顺序时做的一些实验,仔细分析后回答下列问题:

(1)如图1,甲同学将铝丝插入硫酸铜溶液中,未出现任何现象,其原因是
(2)乙同学分别将锌粉与铁丝放入相同浓度的稀盐酸中,发现锌粉会产生气泡的速率比铁丝快,于是得出结论:锌的活动性比铁强,其他同学认为他的方案中有不合理的地方,请你指出
(3)该小组统计了金属分别与冷水、水蒸气的反映情况,如下表所示
根据金属活动性顺序和表中的信息推断,“镁与水蒸气”的反应情况合理的是 (填序号)
A.不反应 B.缓慢反应
C.比镁与冷水反应快 D.比铁与水蒸气反应快
(4)要证明Cu、Fe、Ag的活动性顺序,该小组至少要做的实验(图2)是 (填序号)

(1)如图1,甲同学将铝丝插入硫酸铜溶液中,未出现任何现象,其原因是
(2)乙同学分别将锌粉与铁丝放入相同浓度的稀盐酸中,发现锌粉会产生气泡的速率比铁丝快,于是得出结论:锌的活动性比铁强,其他同学认为他的方案中有不合理的地方,请你指出
(3)该小组统计了金属分别与冷水、水蒸气的反映情况,如下表所示
| 物质 | 镁与冷水 | 铁与冷水 | 铜与冷水 | 铁与水蒸气 | 铜与水蒸气 |
| 反应情况 | 缓慢反应 | 不反应 | 不反应 | 能反应 | 不反应 |
A.不反应 B.缓慢反应
C.比镁与冷水反应快 D.比铁与水蒸气反应快
(4)要证明Cu、Fe、Ag的活动性顺序,该小组至少要做的实验(图2)是
考点:金属活动性顺序及其应用
专题:金属与金属材料
分析:(1)考虑铝丝上的氧化膜的影响.
(2)从外界因素对化学反应速率的影响来考虑.
(3)从表中数据可知温度越高反应越剧烈进行考虑.
(4)在金属活动性顺序中,只有排在氢前的金属可以和稀酸溶液(除稀硝酸外)生成氢气,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,利用这一规律对问题进行判断分析即可.
(2)从外界因素对化学反应速率的影响来考虑.
(3)从表中数据可知温度越高反应越剧烈进行考虑.
(4)在金属活动性顺序中,只有排在氢前的金属可以和稀酸溶液(除稀硝酸外)生成氢气,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,利用这一规律对问题进行判断分析即可.
解答:解:(1)将铝丝插入到硫酸铜溶液中,未出现任何现象,其原因是铝丝表面被氧化,氧化膜(Al2O3)不和硫酸铜反应.
(2)因为锌粉是粉末状,接触面积大,也可能时其反应速率大于铁丝的原因,所以不能证明,应该将两种金属的形状、大小一致.
(3)由铁与冷水不反应,铁与水蒸气反应,说明温度越高反应越剧烈,所以镁与水蒸气反应要比镁与冷水反应剧烈,由镁与冷水能缓慢反应,铁与冷水不反应,说明镁比铁活泼,所以镁与水蒸气的反应要比铁与水蒸气反应快;
(4)用于证明铁、铜、银的金属活动性顺序实验是A、B,因为由A知铜能置换出硝酸银中的银,说明活动性铜>银,B中的铁能置换出硫酸铜中的铜,说明活动性铁>铜,所以可得活动性:铁>铜>银.
故答案为:(1)可能是铝丝表面的氧化膜没有除去;(2)由于所用的金属是锌粉和铁丝,表面积不同,因此不能说明问题;(3)D;(4)AB.
(2)因为锌粉是粉末状,接触面积大,也可能时其反应速率大于铁丝的原因,所以不能证明,应该将两种金属的形状、大小一致.
(3)由铁与冷水不反应,铁与水蒸气反应,说明温度越高反应越剧烈,所以镁与水蒸气反应要比镁与冷水反应剧烈,由镁与冷水能缓慢反应,铁与冷水不反应,说明镁比铁活泼,所以镁与水蒸气的反应要比铁与水蒸气反应快;
(4)用于证明铁、铜、银的金属活动性顺序实验是A、B,因为由A知铜能置换出硝酸银中的银,说明活动性铜>银,B中的铁能置换出硫酸铜中的铜,说明活动性铁>铜,所以可得活动性:铁>铜>银.
故答案为:(1)可能是铝丝表面的氧化膜没有除去;(2)由于所用的金属是锌粉和铁丝,表面积不同,因此不能说明问题;(3)D;(4)AB.
点评:同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.验证三种金属活动性顺序类问题时,一般采取“三取中”的方法进行设计实验,即选取活动性位于中间的那种金属的单质与另两种金属的盐溶液反应;或取中间金属的盐溶液与另两种金属的单质进行反应.

练习册系列答案
相关题目
下列是某合作学习小组对物质进行的分类,正确的是( )
| A、冰、干冰既是纯净物又是化合物 |
| B、盐酸、食醋既是化合物又是酸 |
| C、不锈钢和我们日常生活中使用的硬币都是合成材料 |
| D、纯碱和熟石灰都是碱 |
下面是学生对课本中图表资料的使用情况,其中不正确的是( )
| A、根据金属活动性顺序表,判断金属能否与稀酸反应以及产生氢气的快慢 |
| B、根据元素周期表可判断元素在自然界的含量以及原子序数和相对原子质量 |
| C、根据金属活动性顺序表,判断金属能否与盐溶液反应以后反应的先后 |
| D、根据常见元素及原子团的化合价,判断常见化合物的化学式书写是否正确 |


 小李用如图气体发生装置来制取二氧化碳,老师给他提供了石灰石、无标签的稀盐酸和氯化钠水溶液各一瓶.
小李用如图气体发生装置来制取二氧化碳,老师给他提供了石灰石、无标签的稀盐酸和氯化钠水溶液各一瓶.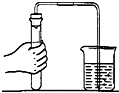 实验室在制取气体时,必须首先检查装置的气密性,如图所示.如果装置不漏气导管口就会有气泡冒出.用分子观点解释产生上述现象的原因.
实验室在制取气体时,必须首先检查装置的气密性,如图所示.如果装置不漏气导管口就会有气泡冒出.用分子观点解释产生上述现象的原因.