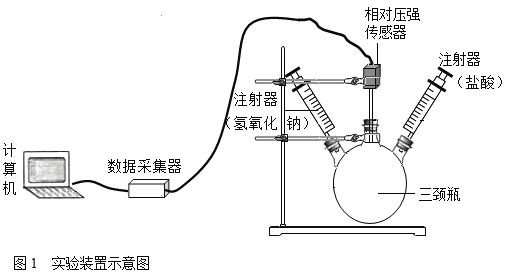
题目内容
【题目】加热氯酸钾和二氧化锰的混合物可以制备氧气,该反应的化学方程式为____________,但实验中发现有刺激性气味的气体产生。请你一起参与探究:
(提出问题)刺激性气味的气体是什么呢?
(猜想假设)
猜想一:臭氧(化学式为O3)。
猜想二:HCl。
猜想三:Cl2
同学们认为猜想二不需要实验验证就可以判断是错误的,理由是____________。
(链接资料)
(1)Cl2 + H2O = HClO + HCl,HClO 在水溶液中可解离出少量H+、Cl、ClO;HClO 具有强氧化性和漂白性,可杀灭细菌病毒,使有色物质褪色;AgNO3 + HCl = AgCl ↓+ HNO3,AgCl 是一种白色沉淀。
(2)臭氧在二氧化锰存在情况下极易分解产生氧气。
(实验探究)
查阅资料后大家认为猜想一是错误的,理由为________。
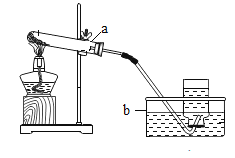
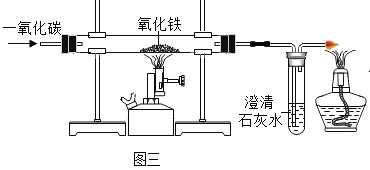
他们进一步做了如下实验:取氯酸钾和二氧化锰的混合物放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管口,看到的现象是____________,再将湿润的蓝色石蕊试纸悬于试管口,试纸____________最终证明猜想三正确。
(反思拓展)
自来水厂常用漂白粉杀菌消毒[主要成分化学式为 Ca(ClO)2在水中起杀菌消毒作用的离子是____________。
【答案】2KClO3![]() 2KCl + 3O2↑ 反应物中不含有氢元素 臭氧在二氧化锰存在情况下极易分解产生氧气 硝酸银溶液变浑浊 先变红色后变无色 ClO
2KCl + 3O2↑ 反应物中不含有氢元素 臭氧在二氧化锰存在情况下极易分解产生氧气 硝酸银溶液变浑浊 先变红色后变无色 ClO
【解析】
加热氯酸钾和二氧化锰的混合物可以制备氧气,这是因为氯酸钾在二氧化锰催化作用下 受热分解生成氯化钾和氧气,该反应的化学方程式为:2KClO3![]() 2KCl + 3O2↑。故填:2KClO3
2KCl + 3O2↑。故填:2KClO3![]() 2KCl + 3O2 ↑。
2KCl + 3O2 ↑。
猜想假设: 同学们认为不需要实验验证就可以判断猜想二是错误的,理由是反应物中不含有氢元素,不可能生成氯化氢。故填:反应物中不含有氢元素。
实验探究: 查阅资料后大家认为猜想一是错误的,理由为臭氧在二氧化锰存在情况下极易分解产生氧气,即使反应生成臭氧,在二氧化锰的作用下也会迅速反应生成氧气;取氯酸钾和二氧化锰的混合物放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管口,看到硝酸银溶液变浑浊,再将湿润的蓝色石蕊试纸悬于试管口,试纸先变红色后变无色,原因是氯气和水反应生成了盐酸和次氯酸,盐酸和硝酸银反应生成白色沉淀氯化银,次氯酸和盐酸显酸性,能使石蕊试液变红色,同时次氯酸具有漂白性,再使颜色褪去,所以证明产生的气体是氯气,最终证明猜想三正确。故填:臭氧在二氧化锰存在情况下极易分解产生氧气;硝酸银溶液变浑浊;先变红色后变无色。
反思拓展:自来水厂常用漂白粉杀菌消毒,主要成分化学式为 Ca(ClO)2,次氯酸钙能和水、二氧化碳反应生成次氯酸,次氯酸能够电离出自由移动的次氯酸根离子,次氯酸根离子具有强氧化性,能够杀灭细菌,因此在水中起杀菌消毒作用的离子是 ClO。故填:ClO。

【题目】K2CO3和KNO3在不同温度时的溶解度如下。
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度(g/100g 水) | K2CO3 | 110 | 114 | 121 | 126 | 139 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
某KNO3样品中含有少量K2CO3,其提纯过程如下:
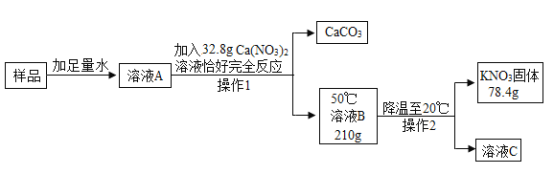
①提纯过程中涉及的化学反应方程式是_____。
②溶液 A 中加 Ca(NO3)2溶液恰好完全反应的目的是_____。下列试剂中可以替代Ca(NO3)2 溶液的是_____(填字母)。
a CaCl2 b Ba(NO3)2 c Ca(OH)2 d BaCl2
③溶液A、B、C 中,一定属于饱和溶液的是_____(填字母)。
④样品中钾元素的质量为_____g(精确到0.1)。
⑤若要测定样品中KNO3 的纯度,还需测定的量是_____。
【题目】闽东毗邻东海,海洋资源十分丰富.从海水中提取氯化钠并以氯化钠和水为原料制取氢氧化钠、氯气等物质的工艺流程图如下:
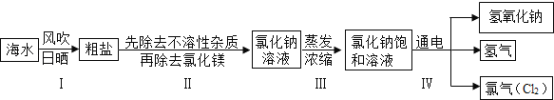
某兴趣小组进行如下实验:
(实验一)除去粗盐中的不溶性杂质
步骤一:用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛10mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐质量为1.4g
步骤二:经过过滤、蒸发,得到3.2g精盐.
(1)计算精盐的产率_________(保留一位小数).
(2)该小组测得的产率偏低,可能的原因是________.
A溶解时未充分搅拌
B蒸发时水分未蒸干
C蒸发时盐粒溅出蒸发皿
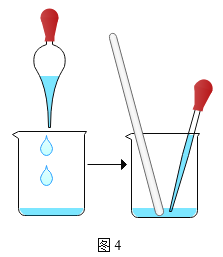
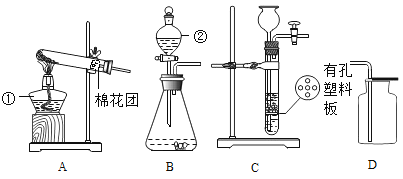
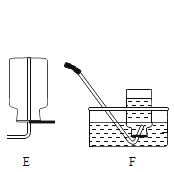
(3)步骤一、二的部分操作如图所示,其中错误的是_________(填字母序号).
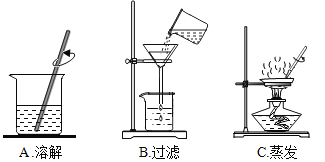
(实验二)探究工艺流程图步骤Ⅱ所得的氯化钠溶液中MgCl2是否除尽,溶液中是否含有CaCl2
[查阅资料]有关物质的溶解性表(20℃)
阴离子 | OH﹣ |
|
Ca2+ | 微 | 不 |
Mg2+ | 不 | 微 |
[进行实验]请你与他们共同完成,并回答所给的问题:
实验步骤 | 实验现象 | 实验结论 |
步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液 | 无明显现象 | 说明MgCl2______(填“已”或“未”)除尽 |
步骤二:往步骤一所得溶液中加入适量的______溶液 | 产生白色沉淀 | 说明溶液中含有CaCl2 |
[拓展思维]
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是________________________________.
(2)写出工艺流程图步骤Ⅳ的化学方程式__________________________.