题目内容
【题目】结合下列图示装置,回答有关问题。

(1)仪器a的名称为_______。
(2)实验室用加热高锰酸钾的制取氧气,可选用的发生装置____(填装置序号),该装置一不足之处是_______,该反应的符号表达式为_______________________。
(3)某同学提出只要将上述A装置和下图所示装置相连接,就可收集并测量生成的氧气的体积,则正确的连接顺序是:

A装置的导管出口→(____)→(____)→c (填接口字母)。
(4)实验室制取二氧化碳时,为控制反应速率应选择的发生装置为___(填装置序号),收集装置为____(填装置序号),验满方法______________________。
(5)某化学兴趣小组用如图所示装置研究以下问题。

【实验】可燃物燃烧的条件
步骤1:水槽中放有一定量热水,水面下a处放一小块白磷,此时观察到白磷不燃烧。
步骤2:在乙中放入二氧化锰和过氧化氢溶液,立即将甲倒扣在乙上。此时观察到甲中水面下降,白磷露出水面,________________。
此实验运用对比的方法研究了可燃物燃烧的一个条件是________________。
【答案】 铁架台 A 试管口未放一团蓬松的棉花 KMnO4![]() K2MnO4+MnO2+O2 e f C E 燃着的木条伸瓶口,(若木条熄灭,则已满) 【答题空10】白磷燃烧产生白烟(无白烟不给分) 可燃物与氧气接触
K2MnO4+MnO2+O2 e f C E 燃着的木条伸瓶口,(若木条熄灭,则已满) 【答题空10】白磷燃烧产生白烟(无白烟不给分) 可燃物与氧气接触
【解析】(1)仪器a铁架台;
(2)实验室用高锰酸钾制取氧气,该反应需要加热,属于固体加热型,故选发生装置A,防止高锰酸钾的固体小颗粒随气流进入导管,应在试管口放一团蓬松的棉花;加热高锰酸钾生成锰酸钾、二氧化锰和氧气,则发生反应的符号表达式为KMnO4![]() K2MnO4+MnO2+O2;
K2MnO4+MnO2+O2;
(3)A装置和图2所示装置相连接,就可收集并测量生成的难溶于水的气体的体积,气体要从短管进入,水才会被压入量筒;
(4)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热,注射器可以控制反应的速率,故选C发生装置;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳验满的方法为:燃着的木条伸瓶口,若木条熄灭,则已满;
(5)在乙中放入二氧化锰和过氧化氢溶液,生成大量氧气,立即将甲倒扣在乙上,则甲内气压增大,故此时观察到甲中水面下降,白磷露出水面,与氧气接触,且是热水,达到白磷的着火点,所以白磷燃烧,步骤1中白磷不燃烧,因为白磷与氧气隔绝,两实验证明了可燃物燃烧需要氧气。

【题目】常温下,小明同学在练习“金属的化学性质”实验操作时,发现几支试管中冒出气泡的速率有快有慢,于是他与小芳同学一起合作进行如下探究。
【提出问题】金属与酸反应的快慢受哪些因素影响呢?
【猜想与假设】A.可能与酸的浓度有关;B.可能与金属的种类有关;C.可能与金属的形状有关。
【设计并实验】小明和小芳进行如下实验。
实验 编号 | 盐酸的 浓度 | 金属 (均取2 g) | 金属的 形状 | 收集50 mL 氢气所需要 的时间/s |
① | 10% | 镁 | 粉状 | 60 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 镁 | 片状 | 102 |
④ | 20% | 铁 | 片状 | 110 |
(1)实验时需将镁片和铁片进行打磨,其目的是______________________________________。
(2)写出铁与稀盐酸反应的化学方程式:________________________________。
【收集证据】
(3)要比较金属的种类对反应快慢的影响,应选择的实验编号是________。
【得出结论】通过上述四个实验,你得出的影响金属与酸反应的因素有________________________。
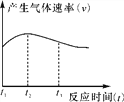
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应。实验测得该反应中产生气体的速率(v)与时间(t)的关系如图所示,你认为在t2~t3时间段内反应速率逐渐减慢的主要原因是________________________________________________________________________。