题目内容
在同温、同压下,气体的分子个数比等于体积比.某工厂排出的废气是SO2和O2的混合气,经定量分析,该混合气中S元素的质量分数为45%.为了消除SO2气体对大气的污染,可将混合气通入烧碱溶液,得到工业原料Na2SO4.请通过计算回答:
(1)混合气中SO2与O2的体积比是______.
(2)若使506m3废气完全转化为Na2SO4,应通入氧气多少立方米?
(1)混合气中SO2与O2的体积比是______.
(2)若使506m3废气完全转化为Na2SO4,应通入氧气多少立方米?
(1)设混合气体中二氧化硫的分子个数为x,氧分子个数为y,则硫元素与氧元素的质量比为
32x:(32x+32y)=45%:55%,求得x:y=9:2,
在同温、同压下,气体的分子个数比等于体积比,所以混合气中SO2与O2的体积比为9:2;
故答案为:(1)9:2;
(2)混合气中SO2的体积为:V(SO2)═506m3×
═414m3 ;
混合气中O2的体积为:V(O2)═506m3-414m3=92 m3
设若使506m3废气完全转化为Na2SO4,参与反应的氧气体积为 x
4NaOH+2SO2 +O2 ═2Na2SO4+2H2O(1分)
2 1
414m3 x
=
x=207m3 ;
应通入氧气的体积为:207m3-92m3=115m3 ;
答:应通入氧气的体积为 115m3 .
32x:(32x+32y)=45%:55%,求得x:y=9:2,
在同温、同压下,气体的分子个数比等于体积比,所以混合气中SO2与O2的体积比为9:2;
故答案为:(1)9:2;
(2)混合气中SO2的体积为:V(SO2)═506m3×
| 9 |
| 11 |
混合气中O2的体积为:V(O2)═506m3-414m3=92 m3
设若使506m3废气完全转化为Na2SO4,参与反应的氧气体积为 x
4NaOH+2SO2 +O2 ═2Na2SO4+2H2O(1分)
2 1
414m3 x
| 2 |
| 414 |
| 1 |
| x |
应通入氧气的体积为:207m3-92m3=115m3 ;
答:应通入氧气的体积为 115m3 .

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
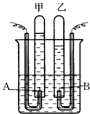 阿伏加德罗曾经总结出一条定律:在同温、同压下,同体积的任何气体都含有相同的分子数.如图是简易电解水的装置图,试根据观察到的实验现象回答下列问题:
阿伏加德罗曾经总结出一条定律:在同温、同压下,同体积的任何气体都含有相同的分子数.如图是简易电解水的装置图,试根据观察到的实验现象回答下列问题: