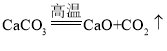题目内容
【题目】小林同学在做探究质量守恒定律实验时,称取2.4g镁条在点燃的条件下与充足的空气反应,其反应的化学方程式为,_____。实验完毕后,称得所得固体的质量小于4.0g
[查阅资料]镁在空气中燃挠时,除了镁与氧气反应外,还可发生反应:
①
②
反应后固体质量小于4.0g是由于发生反应_____(填“①"或“②” )造成的,其理由是_____。
【答案】2Mg+O2![]() 2MgO ② 2.4g镁完全和氮气反应生成氮化镁的质量小于4.0g
2MgO ② 2.4g镁完全和氮气反应生成氮化镁的质量小于4.0g
【解析】
镁在空气中燃烧生成氧化镁,反应的化学方程式为:2Mg+O2![]() 2MgO.
2MgO.
故填:2Mg+O2![]() 2MgO.
2MgO.
[查阅资料]设2.4g镁和氮气反应生成氮化镁的质量为x,

x≈3.3g,
因此反应后固体质量小于4.0g是由于发生反应②造成的,其理由是2.4g镁完全和氮气反应生成氮化镁的质量小于4.0g.
故填:②;2.4g镁完全和氮气反应生成氮化镁的质量小于4.0g。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
(提出问题)
①氧化铜是否也能作氯酸钾分解的催化剂?②它是否比二氧化锰催化效果更好?
(设计并完成实验)
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将x g氯酸钾与1.0g氧化铜均匀混合加热
(实验现象分析)
Ⅲ中x的值应为_____;将实验Ⅰ和Ⅲ比较可证明_____;将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后_____和_____都不变.
(结论)氧化铜还能作氯酸钾分解的催化剂。
(实验反思)实验Ⅱ和Ⅲ对比是为了证明_____。
(提出问题)②双氧水分解速度还和什么因素有关
(设计并完成实验)
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2体积的装置是_____(填编号)

(结论)在相同条件下,双氧水的浓度越大,双氧水分解得越_____。