题目内容
(7分)铝、铁、铜是我们生活中常见的金属。
(1)根据下图,总结金属具有的物理性质有 。
铁锅 铜导线 铝箔
(2)铝制品具有很好的抗腐蚀性能,原因是 。
(3)炼铁厂通常以焦炭(主要成分是C)、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
写出CO与赤铁矿反应的化学方程式 。取少量炼出的生铁粉末放入烧杯中,加入过量稀盐酸,可观察到的现象是 。
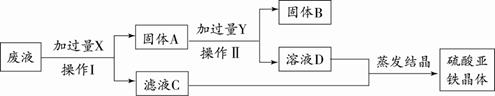
(4)某实验室的废液中含有大量的FeSO4、CuSO4,小刚同学欲从上述废液中回收Cu,并得到副产品FeSO4,设计实验流程如下图所示,回答问题: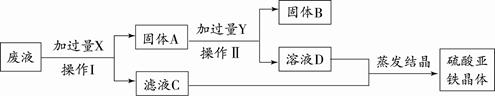
①操作I和操作II的名称是 。
②写出上述流程中所涉及的反应的化学方程式 。
(1)导热性、导电性、延展性
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化。
(3)3CO + Fe2O3  2Fe + 3CO2
2Fe + 3CO2
生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物。
(4)①过滤 ② Fe + CuSO4 ===FeSO4 + Cu ;Fe + H2SO4 ="==" FeSO4 + H2↑(2分,各1分)
解析试题分析:(1)根据图象,结合常见金属的性质分析,可知金属具有的物理性质有:导热性(铁锅)、导电性(导线)、延展性(铝箔)。
(2)铝制品具有很好的抗腐蚀性能,是因为:铝在空气中易与氧气反应,在其表面生成一层致密的氧化铝薄膜,阻止了铝进一步被氧化。
(3)CO与赤铁矿石(氧化铁)在高温下反应生成铁和二氧化碳,故其反应的化学方程式为3CO + Fe2O3  2Fe + 3CO2;
2Fe + 3CO2;
冶炼得到的生铁中含有少量的碳,当向生铁中加入过量稀盐酸时,Fe + 2HCl= FeCl2 + H2↑,其中碳不反应,故可见:铁完全溶解并产生气泡,同时溶液变成浅绿色,反应完全后有黑色不溶物。
(4)对于废液的处理,根据所含的成分是硫酸铜和硫酸亚铁,目的是分离出铜和硫酸亚铁晶体。从实验方案可以看出,要从含硫酸亚铁和硫酸铜的废液中得到铜和硫酸亚铁,第一步要先加过量的铁,把铜置换出来,同时生成硫酸亚铁,即Fe + CuSO4 ="==" FeSO4 + Cu;过滤后所得的固体里含有铁和铜,要想把铁除去,可用稀硫酸与铁反应,即Fe + H2SO4 ="==" FeSO4 + H2↑,而铜与硫酸不反应,过滤就得到铜了,再把两次所得滤液进行蒸发,即可得到硫酸亚铁晶体。
考点:金属的物理性质及用途,常见金属的特性及其应用,金属活动性顺序及其应用,铁的冶炼,金属的回收利用及其重要性,书写化学方程式
点评:本题考查了常见金属的物理性质,铝的氧化性,生铁的冶炼过程及组成,废水的处理,化学方程式的书写等方面的内容,涉及知识面广,考查内容丰富,要求学生在平时的学习中要能加强基础知识的储备。