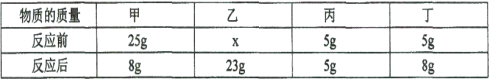
题目内容
【题目】日常使用的金属材料,大多数属于合金。黄铜是以锌作主要添加元素的铜合金.
(1)赤铜(Cu2O)是我国古代制取黄铜的一种原料。Cu2O中铜元素与氧元素的质量比是 .
(2)用来制造弹壳的黄铜只含有锌和铜.将22g弹壳放在盛有100g稀硫酸的烧杯中(硫酸足量),当弹壳不再溶解后,烧杯中混合物的质量是121.8g.计算:
①产生氢气的质量.
②弹壳中铜的质量.
【答案】(1) 8:1;(2)①0.2g②15.5g③15.1%
【解析】(1)物质组成元素的质量比:相对原子质量×原子个数之比.根据赤铜的化学式可知,其中铜元素与氧元素的质量比为:(64×2):(16×1)=128:16=8:1
(2)①根据质量守恒定律可知:反应前后的总质量的差值即为生成的气体—氢气的质量.
②根据题意可知:题中是锌与硫酸反应生成氢气.已知量为氢气的质量,根据化学方程式中氢气与锌的质量关系,先求出参加反应的锌的质量,再进一步求出铜的质量.③ 根据化学方程式中氢气与硫酸锌的质量关系,先求出反应生成的硫酸锌质量.然后再根据反应完毕后,混合物的质量为硫酸锌溶液的质量和铜的质量之和,由此可求出所得溶液的质量.进一步求出所得溶液中硫酸锌的质量分数.具体解题过程如下:
解:①根据题意可知,生成氢气的质量为22g+100g-121.8g=0.2g
②设黄铜中锌的质量为x,生成硫酸锌的质量为y;
Zn+H2SO4==ZnSO4+H2↑
65 161 2
x y 0.2g
![]()
x=6.5g y=16.1g
弹壳中铜的质量为:22g—6.5g=15.5g
③所得硫酸锌溶液的溶质质量分数为:![]() ×100%≈15.1%
×100%≈15.1%
试题分析:(1)根据铜和氧的原子个数和相对原子质量计算元素质量比;(2)根据反应前后的质量差计算生成氢气质量;根据氢气质量及锌与酸反应的方程式计算蛋壳中锌和硫酸锌的质量,从而计算铜的质量及硫酸锌溶液的溶质质量分数.