题目内容
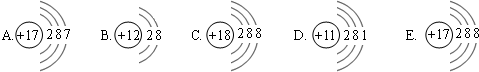
下面是五种粒子的结构示意图
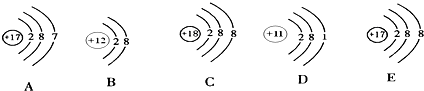
①图中粒子共能表示
②图中表示的阳离子是
③图中表示原子的是

①图中粒子共能表示
四
四
种元素.A所表示的元素属于非金属
非金属
元素(填金属或非金属).②图中表示的阳离子是
Mg2+
Mg2+
(用符号表示),表示的阴离子是Cl-
Cl-
(用符号表示),二者形成化合物的化学式的MgCl2
MgCl2
(用符号表示).③图中表示原子的是
A:Cl、C:Ar、D:Na
A:Cl、C:Ar、D:Na
(填符号).分析:不同种元素最本质的区别是质子数不同,元素的种类由质子数决定,进行解答;
根据原子结构示意图的特点:非金属元素的最外层电子数一般多于4,进行解答;
根据化合物化学式的书写步骤:归类→定序→标价→交叉→约简,进行解答;
根据当核电荷数=质子数=核外电子数,为原子;当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;进行解答.
根据原子结构示意图的特点:非金属元素的最外层电子数一般多于4,进行解答;
根据化合物化学式的书写步骤:归类→定序→标价→交叉→约简,进行解答;
根据当核电荷数=质子数=核外电子数,为原子;当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;进行解答.
解答:解:①根据不同种元素最本质的区别是质子数不同,可知图中有4种不同的质子数,能表示 四 种元素.
根据原子结构示意图的特点:非金属元素的最外层电子数一般多于4,可知A所表示的元素属于 非金属元素;
②当核电荷数=质子数>核外电子数,为阳离子;可知图中粒子的结构示意图可知B中核电荷数=质子数=12>核外电子数=10,为阳离子;表示为 Mg2+;
当核电荷数=质子数<核外电子数,为阴离子;可知图中可知图中粒子的结构示意图可知 E 中核电荷数=质子数=17>核外电子数=18为阴离子,表示为 Cl-;
镁元素 的化合价为+2,氯元素的化合价为-1,二者形成化合物的化学式为 MgCl2 ;
③根据当核电荷数=质子数=核外电子数,为原子;由粒子的结构示意图可知图中表示原子的是:A:Cl、C:Ar、D:Na故答案为:①四;非金属; ②Mg2+;Cl-; MgCl2; ③A:Cl、C:Ar、D:Na.
根据原子结构示意图的特点:非金属元素的最外层电子数一般多于4,可知A所表示的元素属于 非金属元素;
②当核电荷数=质子数>核外电子数,为阳离子;可知图中粒子的结构示意图可知B中核电荷数=质子数=12>核外电子数=10,为阳离子;表示为 Mg2+;
当核电荷数=质子数<核外电子数,为阴离子;可知图中可知图中粒子的结构示意图可知 E 中核电荷数=质子数=17>核外电子数=18为阴离子,表示为 Cl-;
镁元素 的化合价为+2,氯元素的化合价为-1,二者形成化合物的化学式为 MgCl2 ;
③根据当核电荷数=质子数=核外电子数,为原子;由粒子的结构示意图可知图中表示原子的是:A:Cl、C:Ar、D:Na故答案为:①四;非金属; ②Mg2+;Cl-; MgCl2; ③A:Cl、C:Ar、D:Na.
点评:本题考查学生对粒子的结构示意图含义的理解,根据核电荷数、质子数与核外电子数的关系辨别微粒种类方法的掌握与应用的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目