题目内容
(1)某同学按右图装置对质量守恒定律进行实验探究,反应前天平平衡,然后将稀盐酸倒入烧杯中与碳酸钠充分反应后,再称量,观察到反应后天平不平衡,天平指针
向 偏转(填“左”或“右”)。该反应 质量守恒定律(填“遵守”或“不遵守”)。
反应后天平不平衡的原因是 。
(2)由质量守恒定律可知,化学反应前后,一定不变的是 ;(填序号)
①原子种类 ②原子数目 ③分子种类
④分子数目 ⑤元素种类 ⑥物质种类

(1) 右 遵守 产生的二氧化碳气体逸到空气中去了
(2) ①②⑤

某化学兴趣小组对一包干燥的红色粉末组成进行探究,请你参与并回答有关问题。
【老师提醒】它由铜、氧化铁两种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成有:
①只有铜;②只有 ;③是铜、氧化铁的额混合物
【资料获悉】①铜在氯化铁溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
②氧化铁能被稀盐酸溶解:Fe2O3+6HCl=2FeCl3+3H2O
【实验探究】(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,震荡后观察,发现固
体全部溶解。甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为
 (填“甲”或“一”)的观点正确。
(填“甲”或“一”)的观点正确。
(2)丙同学为进一步确定红色粉末的组成,称取该粉末5g装
入硬质玻璃管中,按右图在同分橱中进行试验。开始时缓缓通
入CO气体,过一段时间后再加热使其充分反应。待反应完全后,
停止加热,仍继续铜CO气体直至玻璃管冷却。反应前后称量
相关装置和物质的总质量,其数据如下表:
| 反应前 | 反应后 | |
| Ⅰ组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ组 | 洗气瓶和所盛溶液的总质量为180.0g | 洗气瓶和瓶中物质的总质量为183.1g |
【讨论交流】(1)在装置A中先通入CO气体的作用是 。
(2)应该选择 组的实验数据计算确定红色粉末的组成。最终计算结果表明:该红色粉末的组成是猜想中的第
组(填序号)
(3)写出A装置中发生的化学方程式 。
(4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接? (填“需要”或“不需要”),
理由是 。
【反思评价】丁同学指出:从环保角度,上图装置有严重不足之处。你认为应该如何改进?
。
 某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨:
某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨: 某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨:
某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨:
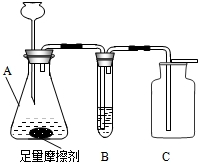
 (2008?湛江)某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨:
(2008?湛江)某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨: