题目内容
(2004?河北)某化学兴趣小组采集一些石灰石样品,进行了下列实验:取4份质量不同的石灰石样品,分别与27.0克相同溶质质量分数的稀盐酸充分反应后(石灰石样品中的杂质即不溶于水,也不与盐酸反应),经过滤、干燥,称量剩余固体的质量.剩余固体的质量与所取样品质量的关系如下表所示:| 实验序号 | 石灰石样品质量/g | 稀盐酸的质量/g | 剩余固体质量/g |
| 1 | 1 | 27 | 0.1 |
| 2 | 2 | 27 | 0.2 |
| 3 | 3 | 27 | 0.3 |
| 4 | 4 | 27 | 1.3 |
(2)所用稀盐酸中溶质的质量分数.
【答案】分析:由反应质量表可知,前三次实验中石灰石中碳酸钙完全反应,而第四次实验因盐酸量不足,石灰石中碳酸钙未能完全反应;1.0g石灰石完全反应剩余0.1g固体可知,1.0g该石灰石样品中含碳酸钙质量=1.0g-0.1g=0.9g,含杂质0.1g;
因此,第四次实验中参加反应的碳酸钙质量=4.0g-1.3g=2.7g;
计算所用稀盐酸中溶质质量分数时,应选取盐酸完全反应的第四次实验所记录数据进行,而前三次实验因盐酸未全部参加反应,不能用作计算稀盐酸的溶质质量分数.
解答:解:(1)由碳酸钙完全反应的前三次实验数据可知:每1.0g该石灰石样品中含碳酸钙质量=1.0g-0.1g=0.9g,
该组样品中碳酸钙的质量分数=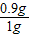 ×100%=90%;
×100%=90%;
(2)由第4次实验的数据得,消耗碳酸钙的质量=4g-1.3g=2.7g
设27.0g稀盐酸中HCl质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
2.7g x
100:73=2.7g:x
x=1.971g
稀盐酸中溶质的质量分数=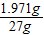 ×100%=7.3%
×100%=7.3%
答:(1)石灰石样品中碳酸钙的质量分数为90%;
(2)所用稀盐酸中溶质的质量分数为7.3%.
点评:第四次实验中所剩余的1.3g固体为杂质及未反应完的碳酸钙的混合物,反应后前后质量差即为反应所消耗的碳酸钙质量.
因此,第四次实验中参加反应的碳酸钙质量=4.0g-1.3g=2.7g;
计算所用稀盐酸中溶质质量分数时,应选取盐酸完全反应的第四次实验所记录数据进行,而前三次实验因盐酸未全部参加反应,不能用作计算稀盐酸的溶质质量分数.
解答:解:(1)由碳酸钙完全反应的前三次实验数据可知:每1.0g该石灰石样品中含碳酸钙质量=1.0g-0.1g=0.9g,
该组样品中碳酸钙的质量分数=
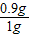 ×100%=90%;
×100%=90%;(2)由第4次实验的数据得,消耗碳酸钙的质量=4g-1.3g=2.7g
设27.0g稀盐酸中HCl质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
2.7g x
100:73=2.7g:x
x=1.971g
稀盐酸中溶质的质量分数=
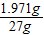 ×100%=7.3%
×100%=7.3%答:(1)石灰石样品中碳酸钙的质量分数为90%;
(2)所用稀盐酸中溶质的质量分数为7.3%.
点评:第四次实验中所剩余的1.3g固体为杂质及未反应完的碳酸钙的混合物,反应后前后质量差即为反应所消耗的碳酸钙质量.

练习册系列答案
相关题目
(2004?河北)某化学兴趣小组采集一些石灰石样品,进行了下列实验:取4份质量不同的石灰石样品,分别与27.0克相同溶质质量分数的稀盐酸充分反应后(石灰石样品中的杂质即不溶于水,也不与盐酸反应),经过滤、干燥,称量剩余固体的质量.剩余固体的质量与所取样品质量的关系如下表所示:
试计算:(1)石灰石样品中碳酸钙的质量分数.
(2)所用稀盐酸中溶质的质量分数.
| 实验序号 | 石灰石样品质量/g | 稀盐酸的质量/g | 剩余固体质量/g |
| 1 | 1 | 27 | 0.1 |
| 2 | 2 | 27 | 0.2 |
| 3 | 3 | 27 | 0.3 |
| 4 | 4 | 27 | 1.3 |
(2)所用稀盐酸中溶质的质量分数.
(2004?河北)某化学兴趣小组采集一些石灰石样品,进行了下列实验:取4份质量不同的石灰石样品,分别与27.0克相同溶质质量分数的稀盐酸充分反应后(石灰石样品中的杂质即不溶于水,也不与盐酸反应),经过滤、干燥,称量剩余固体的质量.剩余固体的质量与所取样品质量的关系如下表所示:
试计算:(1)石灰石样品中碳酸钙的质量分数.
(2)所用稀盐酸中溶质的质量分数.
| 实验序号 | 石灰石样品质量/g | 稀盐酸的质量/g | 剩余固体质量/g |
| 1 | 1 | 27 | 0.1 |
| 2 | 2 | 27 | 0.2 |
| 3 | 3 | 27 | 0.3 |
| 4 | 4 | 27 | 1.3 |
(2)所用稀盐酸中溶质的质量分数.