题目内容
【题目】如图是稀盐酸和氢氧化钠溶液反应的pH变化曲线图。以下说法正确的是( )
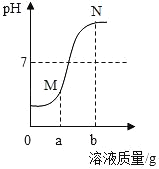
A. 该反应是向氢氧化钠溶液中滴加稀盐酸
B. M点和N点共有的离子只有一种
C. 检验M点溶液的溶质可先滴加足量Na2CO3,静置后再滴加少量AgNO3溶液
D. 检验N点溶液的溶质可先滴加足量的Cu(NO3)2,静置后再滴加少量AgNO3溶液
【答案】D
【解析】
A、图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸,故选项说法错误。
B、M点和N点的溶液中均含有氯化钠,共有的离子有钠离子和氯离子两种,故选项说法错误。
C、M点时溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和NaCl,检验M点溶液的溶质可先滴加足量Na2CO3,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,静置后再滴加少量AgNO3溶液,无法确定氯化钠是中和反应生成的,还是碳酸钠与稀盐酸反应生成的,故选项说法错误。
D、N点时溶液的pH大于7,溶液显碱性,说明氢氧化钠过量,所得溶液中的溶质为NaOH和NaCl,先滴加足量的Cu(NO3)2,反应生成氢氧化铜沉淀和硝酸钠,静置后再滴加少量AgNO3溶液,若产生白色沉淀,说明含有氯化钠,故选项说法正确。
故选:D。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目