题目内容
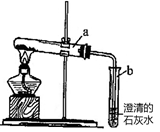
(7分+4分奖励分)我们知道,二氧化碳能使澄清石灰水变浑浊,其反应用化学方程式表示为: ;王天然同学查阅资料发现:氢氧化钠与氢氧化钙性质十分相似,也能与二氧化碳发生反应,但此反应无明显实验现象,其反应的化学方程式为:CO2 + 2NaOH = Na2CO3 + H2O。她为了能证明氢氧化钠与二氧化碳在溶液中确实发生了反应,设计了如下方案。请你将她设计的方案补充完整:
| | 实验步骤和方法 | 实验现象 | 实验结论 | 启示 |
| 方案1 | 向一个软塑料瓶中充满二氧化碳,再注入少量氢氧化钠溶液,盖紧瓶盖,摇动塑料瓶。 | | | 从反应物二氧化碳的减少(压强减小)来判断反应的发生 |
| 方案2 | | | | 从生成物碳酸钠的存在来判断反应的发生 |
(注意:若答对本小题奖励4分,化学试卷总分不超过60分。)
【理由】
【设计实验】
CO2 + Ca(OH)2 = CaCO3↓ + H2O(2分)
理由是:将一个软塑料瓶中充满二氧化碳,再注入水,盖紧瓶盖,摇动塑料瓶,塑料瓶也能变瘪。因为二氧化碳能溶于水,且在溶于水的同时,也能与水发生反应,使瓶内气压减小。(1分) 实验步骤和方法 实验现象 实验结论 启示 方案1 塑料瓶变瘪 氢氧化钠与二氧化碳发生了反应 方案2 向氢氧化钠溶液持续通入二氧化碳,一段时间后,再向此液体加入稀盐酸. 液体中有气泡产生 氢氧化钠与二氧化碳发生了反应
进一步设计的实验为:将两个同样大小的软塑料瓶中分别充满二氧化碳,再分别注入等量的水和氢氧化钠溶液,盖紧瓶盖,摇动塑料瓶,比较塑料瓶变瘪的程度。(3分)
解析试题分析:石灰水是Ca(OH)2的水溶液,与CO2反应生成难溶物CaCO3和H2O,其化学方程式为CO2 + Ca(OH)2 = CaCO3↓ + H2O;
方案1:二氧化碳与氢氧化钠反应会使软塑料瓶内压强减小,瓶子变瘪,从而证明二氧化碳与氢氧化钠发生了反应;
方案2:碳酸钠与稀盐酸反应有二氧化碳气体生成,产生气泡,NaOH与稀盐酸反应生成氯化钠与水,无现象,从而证明两者发生了反应;
[理由]由于二氧化碳能溶于水且与水反应,也能导致软塑料瓶内压强减小,瓶子变瘪。
[设计实验]可以通过二者的对比实验,通过比较两实验软塑料瓶变瘪的程度来证明。
考点:考查二氧化碳的性质和实验设计与评价。
点评:对于某些化学反应现象不明显或不足以说明问题时,要千方百计通过设计出具有明显现象的实验,来准确推知和认识化学反应。

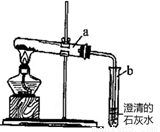
(7分+4分奖励分)我们知道,二氧化碳能使澄清石灰水变浑浊,其反应用化学方程式表示为: ;王天然同学查阅资料发现:氢氧化钠与氢氧化钙性质十分相似,也能与二氧化碳发生反应,但此反应无明显实验现象,其反应的化学方程式为:CO2 + 2NaOH = Na2CO3 + H2O。她为了能证明氢氧化钠与二氧化碳在溶液中确实发生了反应,设计了如下方案。请你将她设计的方案补充完整:
|
|
实验步骤和方法 |
实验现象 |
实验结论 |
启示 |
|
方案1 |
向一个软塑料瓶中充满二氧化碳,再注入少量氢氧化钠溶液,盖紧瓶盖,摇动塑料瓶。 |
|
|
从反应物二氧化碳的减少(压强减小)来判断反应的发生 |
|
方案2 |
|
|
|
从生成物碳酸钠的存在来判断反应的发生 |
【反思】方明同学认为王天然同学设计的方案1中,不能得出二氧化碳与氢氧化钠是否确实发生了反应,理由是什么?请你进一步设计实验把王天然的方案1补充完整。
(注意:若答对本小题奖励4分,化学试卷总分不超过60分。)
【理由】
【设计实验】
(7分) 在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附粘附着白色物质。
【提出问题】黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是 ,白色物质可能是Na2O或 ;
乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是 。
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O + H2O = 2NaOH
【实验探究】甲同学对白色物质进行实验探究。
|
|
实 验 操 作 |
实验现象 |
结 论 |
|
方案 1 |
取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质 为Na2O |
|
方案 2 |
取样品少量放入试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
白色物质 是 |
|
静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【反思评价】丙同学认为方案1得到的结论不正确,理由是 。
【得出结论】钠在二氧化碳中燃烧的化学方程式为 。
通过以上探究,你还能获得哪些结论,请写出两条。(答对本小题将奖励4分,但全卷总分不超过60分)
⑴ ,
⑵ 。