题目内容
珍珠中某些成分具有药用价值,提取的过程是先将珍珠中大量的碳酸钙用浓盐酸除去(设其它成分不与盐酸反应,也不含钙元素),经分析珍珠中含碳酸钙的质量分数为94%.
(1)计算珍珠中钙元素的质量分数.
(2)欲除去1kg珍珠中的碳酸钙至少需含HCl质量分数为36.5%的浓盐酸多少千克?
解:(1)碳酸钙中钙元素的质量分数=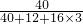 ×100%=40%,
×100%=40%,
珍珠中钙元素的质量分数=94%×40%=37.6%;
(2)设需纯HCl的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
1kg×94% x
∴100:73=(1kg×94%):x,
解之得:x=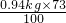 =0.6862kg;
=0.6862kg;
则至少需要浓盐酸的质量= =1.88kg.
=1.88kg.
答:(1)珍珠中含钙37.6%.
(2)需浓盐酸1.88kg.
分析:(1)先根据“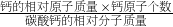 ×100%”计算出碳酸钙中钙元素的质量分数,然后再乘以珍珠中含碳酸钙的质量分数,就是珍珠中钙元素的质量分数;
×100%”计算出碳酸钙中钙元素的质量分数,然后再乘以珍珠中含碳酸钙的质量分数,就是珍珠中钙元素的质量分数;
(2)根据碳酸钙与盐酸反应的化学方程式和碳酸钙的质量,列出比例式,就可计算出需纯HCl的质量,然后根据“溶质质量÷质量分数=溶液质量”计算即可.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
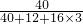 ×100%=40%,
×100%=40%,珍珠中钙元素的质量分数=94%×40%=37.6%;
(2)设需纯HCl的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
1kg×94% x
∴100:73=(1kg×94%):x,
解之得:x=
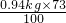 =0.6862kg;
=0.6862kg;则至少需要浓盐酸的质量=
 =1.88kg.
=1.88kg.答:(1)珍珠中含钙37.6%.
(2)需浓盐酸1.88kg.
分析:(1)先根据“
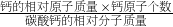 ×100%”计算出碳酸钙中钙元素的质量分数,然后再乘以珍珠中含碳酸钙的质量分数,就是珍珠中钙元素的质量分数;
×100%”计算出碳酸钙中钙元素的质量分数,然后再乘以珍珠中含碳酸钙的质量分数,就是珍珠中钙元素的质量分数;(2)根据碳酸钙与盐酸反应的化学方程式和碳酸钙的质量,列出比例式,就可计算出需纯HCl的质量,然后根据“溶质质量÷质量分数=溶液质量”计算即可.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
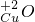 --氧化铜中铜元素的化合价为+2价
--氧化铜中铜元素的化合价为+2价