题目内容
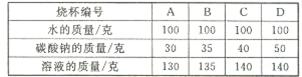
如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.(1)为测定室温下Na2CO3的溶解度,在编号为A、B、C、D的四个烧杯中各加入室温下的水100g,并分别加入取自实验室的Na2CO3固体,搅拌至充分溶解,实验数据记录如表:
| 烧杯编号 | A | B | C | D |
| 水的质量/克 | 100 | 100 | 100 | 100 |
| 加入Na2CO3的质量/克 | 30 | 35 | 40 | 50 |
| 溶液的质量/克 | 130 | 135 | 140 | 140 |
______.
(2)为确定食用纯碱的纯度,称取自带的食用纯碱5.4g放入烧杯中,再滴加盐酸至刚好完全反应,共用去稀盐酸25g,得溶质质量为28.2g(杂质溶于水且与盐酸不反应),通过计算判断该食用纯碱中碳酸钠的质量分数是否与包装袋信息相符.(计算结果精确到0.1%)

【答案】分析:(1)根据实验数据可知室温下的水100g最多溶解40g碳酸钠进行解答;
(2)根据反应前后质量减少的为二氧化碳的质量进行解答.
解答:解:(1)由实验数据可知室温下的水100g最多溶解40g碳酸钠,所以烧杯编号为C、D中的溶液是饱和溶液,室温下,Na2CO3的溶解度是40g;
(2)设食用纯碱中碳酸钠的质量分数为x.
二氧化碳的质量=5.4g+25g-28.2g=2.2g
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
5.4g×x 2.2g

x=98.1%
98.1%>98%
所以与包装袋信息相符
答:该食用纯碱中碳酸钠的质量分数与包装袋信息相符.
点评:本题考查饱和溶液的判断和溶解度的简单计算,学生利用在该条件下有固体不能继续溶解来判断是否为饱和溶液是解答的关键.
(2)根据反应前后质量减少的为二氧化碳的质量进行解答.
解答:解:(1)由实验数据可知室温下的水100g最多溶解40g碳酸钠,所以烧杯编号为C、D中的溶液是饱和溶液,室温下,Na2CO3的溶解度是40g;
(2)设食用纯碱中碳酸钠的质量分数为x.
二氧化碳的质量=5.4g+25g-28.2g=2.2g
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
5.4g×x 2.2g

x=98.1%
98.1%>98%
所以与包装袋信息相符
答:该食用纯碱中碳酸钠的质量分数与包装袋信息相符.
点评:本题考查饱和溶液的判断和溶解度的简单计算,学生利用在该条件下有固体不能继续溶解来判断是否为饱和溶液是解答的关键.

练习册系列答案
相关题目
 如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.
如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.
(1)为测定室温下Na2CO3的溶解度,在编号为A、B、C、D的四个烧杯中各加入室温下的水100g,并分别加入取自实验室的Na2CO3固体,搅拌至充分溶解,实验数据记录如表:
| 烧杯编号 | A | B | C | D |
| 水的质量/克 | 100 | 100 | 100 | 100 |
| 加入Na2CO3的质量/克 | 30 | 35 | 40 | 50 |
| 溶液的质量/克 | 130 | 135 | 140 | 140 |
______.
(2)为确定食用纯碱的纯度,称取自带的食用纯碱5.4g放入烧杯中,再滴加盐酸至刚好完全反应,共用去稀盐酸25g,得溶质质量为28.2g(杂质溶于水且与盐酸不反应),通过计算判断该食用纯碱中碳酸钠的质量分数是否与包装袋信息相符.(计算结果精确到0.1%)
 (2013?嘉兴)如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.
(2013?嘉兴)如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.
 (1)为测定室温下Na2CO3的溶解度,在编号为A、B、C、D的四个烧杯中各加入室温下的水100g。并
(1)为测定室温下Na2CO3的溶解度,在编号为A、B、C、D的四个烧杯中各加入室温下的水100g。并 分别加入取自实验室的Na2CO3固体,搅拌至充分溶解。实验数据记录如下表:
分别加入取自实验室的Na2CO3固体,搅拌至充分溶解。实验数据记录如下表: 纯碱5.4g放人烧杯中,再滴加盐酸至刚好完全反应,共用去
纯碱5.4g放人烧杯中,再滴加盐酸至刚好完全反应,共用去 稀盐酸25g,得溶液质量为28.2g(反应的化学方程式为:2HC
稀盐酸25g,得溶液质量为28.2g(反应的化学方程式为:2HC