题目内容
将含有杂质的铁屑30g与足量的稀盐酸反应(杂质不反应)生成标准状态下的氢气11.2 L(标准状态下的氢气的密度为0.0893g/L)试求铁屑中铁的质量分数.
解:设铁屑中铁的质量分数为x.
Fe+2HCl=FeCl2+H2↑
56 2
30g×x 0.0893g/L×11.2L
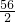 =
= ,x≈93.3%
,x≈93.3%
答:铁屑中铁的质量分数为93.3%.
分析:由氢气的体积和密度可以计算出氢气的质量,由氢气的质量根据铁与盐酸反应的化学方程式可以计算出铁的质量,由铁和铁屑的质量可以计算出铁屑中铁的质量分数.
点评:本题考查含杂质物质的化学方程式计算,难度较大.计算时要先将体积换算成质量,然后再进行计算.
Fe+2HCl=FeCl2+H2↑
56 2
30g×x 0.0893g/L×11.2L
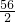 =
= ,x≈93.3%
,x≈93.3%答:铁屑中铁的质量分数为93.3%.
分析:由氢气的体积和密度可以计算出氢气的质量,由氢气的质量根据铁与盐酸反应的化学方程式可以计算出铁的质量,由铁和铁屑的质量可以计算出铁屑中铁的质量分数.
点评:本题考查含杂质物质的化学方程式计算,难度较大.计算时要先将体积换算成质量,然后再进行计算.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目