题目内容
【题目】从多角度认识溶液,有助于我们更好地了解其在生产生活中的重要作用。
(1)溶液的形成
将适量调味品加入水中,充分搅拌后不能形成溶液的是(填标号)。
A.食盐
B.蔗糖
C.花生油
D.酒精
(2)溶液的配制
如图是配制50g溶质质量分数为5%的NaCl溶液的实验操作示意图.结合图示回答下列问题: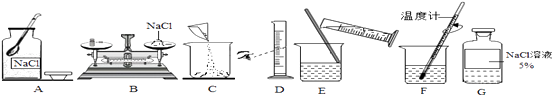
①请找出图中的错误加以改正(写出一处即可):。
②需要称量氯化钠质量是g,需要水的质量是g。
③配制时应选择“50”mL的量筒,量取水时,如果乙同学按照图D方法读数,配制的其余操作准确规范,则所得溶液溶质质量分数(填“小于”、“等于”或“大于”)5%。
④将配好的溶液装入试剂瓶并贴上标签如图G所示。
(3)溶液的性质
根据下图中a、b、c三种物质的溶解度曲线,回答下列问题: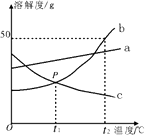
①P点表示。
②t2℃,a、b、c三种物质的溶解度大小关系为。
③t2℃时,30gb物质加入到50g水中充分溶解后,所得溶液是(填“饱和”或“不饱和”)溶液。
【答案】
(1)C
(2)A中瓶盖应该倒放(或者B中砝码和物品的位置应该对调、D中读数时眼睛应该与凹液面最低处保持水平、F中应该把温度计换成玻璃棒等),2.5,47.5,小于
(3)P点表示t1℃,b、c两种物质的溶解度相等,t2℃,a、b、c三种物质的溶解度大小关系为b>a>c,是饱和溶液
【解析】(1) 食盐、酒精和蔗糖都能溶于水,形成溶液,而花生油不溶于水,不能形成溶液;
(2)①瓶塞要倒放在桌面上,否则会沾上杂质污染试剂,该同学采用“左码右物”称量氯化钠,用温度计搅拌;②溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为5%的氯化钠溶液,需氯化钠的质量=50g×5%=2.5g;水的质量为50g-2.5g=47.5g ;③某同学在量取所需的水时,该同学仰视量筒内液面的最低处时进行读数,会造成读数比实际液体体积小,会造成实际量取的水的体积偏大,则所得溶液溶质质量分数偏小;
(3)①据图可知, P点表示t1℃,b、c两种物质的溶解度相等;②据图分析可知,t2℃,a、b、c三种物质的溶解度大小关系为b>a>c;③ t2℃时,b的溶解度是50 g,则50 g水中最多溶解25 gb,故t2℃时,30gb物质加入到50g水中充分溶解后,所得溶液是饱和溶液.
所以答案是:(1)C;(2)A中瓶盖应该倒放(或者B中砝码和物品的位置应该对调、D中读数时眼睛应该与凹液面最低处保持水平、F中应该把温度计换成玻璃棒等);2.5;47.5;小于;(3)P点表示t1℃,b、c两种物质的溶解度相等;t2℃,a、b、c三种物质的溶解度大小关系为b>a>c;是饱和溶液.
【考点精析】本题主要考查了固体溶解度曲线及其作用的相关知识点,需要掌握1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和)才能正确解答此题.

