题目内容
为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品盒足量的溶质质量分数为10%的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通一会氮气.(样品中其它不与稀硫酸反应)
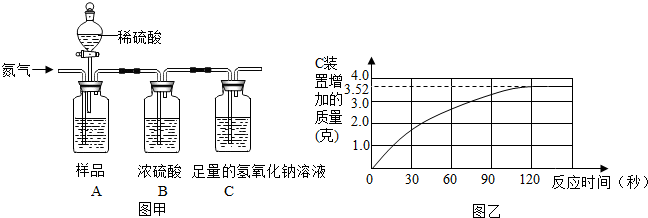
(1)实验前,先往A装置通入一会氮气的目的是 .
(2)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少?(碳酸钠与稀硫酸反应的化学方程式:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑)
(3)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由 .

(1)实验前,先往A装置通入一会氮气的目的是
(2)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少?(碳酸钠与稀硫酸反应的化学方程式:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑)
(3)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由
考点:根据化学反应方程式的计算,酸的物理性质及用途
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)实验前,先往A装置通入一会氮气的目的是避免装置内原有的二氧化碳对实验的干扰;
(2)根据二氧化碳的质量,结合碳酸钠与稀硫酸反应的化学方程式,即可解答;
(3)浓盐酸具有挥发性,挥发出的气体被C装置中的氢氧化钠溶液吸收,造成实验中C装置增加的质量会偏大.
(2)根据二氧化碳的质量,结合碳酸钠与稀硫酸反应的化学方程式,即可解答;
(3)浓盐酸具有挥发性,挥发出的气体被C装置中的氢氧化钠溶液吸收,造成实验中C装置增加的质量会偏大.
解答:解:(1)实验前,先往A装置通入一会氮气的目的是排净瓶内空气避免装置内原有的二氧化碳对实验的干扰;
(2)由图可知生成二氧化碳质量为3.52g,
设,纯碱样品中含碳酸钠的质量为x,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 3.52g
=
x=8.48g
该食用纯碱中碳酸钠的质量分数是:
×100%=84.8%;
(3)浓盐酸具有挥发性,挥发出的气体被C装置中的氢氧化钠溶液吸收,造成实验中C装置增加的质量会偏大.
答案:(1)避免装置内原有的二氧化碳对实验的干扰;
(2)该食用纯碱中碳酸钠的质量分数是84.8%;
(3)浓盐酸具有挥发性,挥发出的气体被C装置中的氢氧化钠溶液吸收.
(2)由图可知生成二氧化碳质量为3.52g,
设,纯碱样品中含碳酸钠的质量为x,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 3.52g
| 106 |
| x |
| 44 |
| 3.52g |
x=8.48g
该食用纯碱中碳酸钠的质量分数是:
| 8.48g |
| 10g |
(3)浓盐酸具有挥发性,挥发出的气体被C装置中的氢氧化钠溶液吸收,造成实验中C装置增加的质量会偏大.
答案:(1)避免装置内原有的二氧化碳对实验的干扰;
(2)该食用纯碱中碳酸钠的质量分数是84.8%;
(3)浓盐酸具有挥发性,挥发出的气体被C装置中的氢氧化钠溶液吸收.
点评:本题主要考查了根据化学方程式计算,通过练习,培养学生按照化学的特点去进行思维的良好习惯和熟练的计算技能.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目

 今年我市连续出现了雾霾天气,使很多人患上咳嗽、气喘等呼吸疾病,也给
今年我市连续出现了雾霾天气,使很多人患上咳嗽、气喘等呼吸疾病,也给
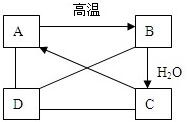 有A、B、C、D四种物质,如图所示:A、B、C在一定条件下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀.
有A、B、C、D四种物质,如图所示:A、B、C在一定条件下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀. 根据如图装置,回答下列问题:
根据如图装置,回答下列问题: