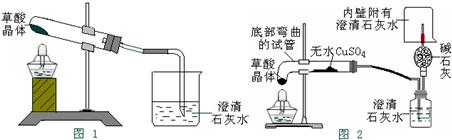
题目内容
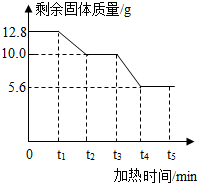 草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解.小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如右图所示.请回答下列问题:
草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解.小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如右图所示.请回答下列问题:(1)t1~t2时问段内固体质量减少的原因是产生了一种极易与血红蛋白结合的有毒气体,该气体的化学式为
(2)t2~t3时间段内固体质量不变的原因是
(3)t3~t4时间段内反应的化学方程式为
(4)小强和小明两位同学另取12.8g草酸钙固体加热一段时间后,对剩余固体的成分进行探究.
【查阅资料】CaC2O4能与稀盐酸反应,其反应的化学方程式为:CaC2O4+2HCl=CaCl2+H2C2O4;草酸(H2C2O4)是一种可溶于水的酸.
【设计方案并实验】
| 同学 | 实验操作 | 实验现象 | 结论 |
| 小强 | 取少量固体放入烧杯中,加适量 水并搅拌.静置后,取上层清夜 于试管中,滴加紫色石蕊试液 |
溶液变蓝色 | 剩余固体中一定含有 一定不含有 可能含有 |
| 小明 | 另取少量固体放入试管中,加足 量稀盐酸 |
有气体产生 | 剩余固体中一定含有 |
分析:(1)根据草酸钙的化学式为CaC2O4,利用元素守恒和物质性质和组成来分析;
(2)物质的分解需要达到一定的温度,根据温度来分析;
(3)根据碳酸钙中的元素来推测生成物,并写化学方程式;
(4)根据物质的性质和反应的现象来设计,利用溶液为蓝色,说明溶液为碱性,则推出已经发生了碳酸钙的分解反应;
根据固体和盐酸反应有气体生成,利用元素守恒可知,剩余固体的成分为氧化钙、碳酸钙,结合图象来解答.
(2)物质的分解需要达到一定的温度,根据温度来分析;
(3)根据碳酸钙中的元素来推测生成物,并写化学方程式;
(4)根据物质的性质和反应的现象来设计,利用溶液为蓝色,说明溶液为碱性,则推出已经发生了碳酸钙的分解反应;
根据固体和盐酸反应有气体生成,利用元素守恒可知,剩余固体的成分为氧化钙、碳酸钙,结合图象来解答.
解答:解:(1)根据草酸钙的组成元素,产生了一种极易与血红蛋白结合的有毒气体应为CO,大理石的主要成分为碳酸钙,可知草酸钙分解生成碳酸钙和一氧化碳,故答案为:CO; CaC2O4
CaCO3+CO↑.
(2)因物质分解需要达到一定的温度,固体质量不变时可说明碳酸钙没有分解,故答案为:草酸钙已完全分解,但尚未达到碳酸钙的分解温度.
(3)t3~t4时间段内固体质量在减小,则碳酸钙分解,根据元素可知生成氧化钙和二氧化碳,
故答案为:CaCO3
CaO+CO2↑.
(4)[设计方案并实验】因上层清液加紫色的石蕊后变蓝色,则说明剩余固体中有氧化钙,此时草酸钙应分解完全,碳酸钙分解生成氧化钙,但可能碳酸钙分解不完全,又因碳酸钙与盐酸反应生成二氧化碳气体,可说明碳酸钙的存在,故答案为:
因t3~t4时间段内反应的化学方程式为CaCO3
CaO+CO2↑,而剩余固体中根据实验可知有碳酸钙和氧化钙,
故答案为:t3~t4.
| ||
(2)因物质分解需要达到一定的温度,固体质量不变时可说明碳酸钙没有分解,故答案为:草酸钙已完全分解,但尚未达到碳酸钙的分解温度.
(3)t3~t4时间段内固体质量在减小,则碳酸钙分解,根据元素可知生成氧化钙和二氧化碳,
故答案为:CaCO3
| ||
(4)[设计方案并实验】因上层清液加紫色的石蕊后变蓝色,则说明剩余固体中有氧化钙,此时草酸钙应分解完全,碳酸钙分解生成氧化钙,但可能碳酸钙分解不完全,又因碳酸钙与盐酸反应生成二氧化碳气体,可说明碳酸钙的存在,故答案为:
| 同学 | 实验操作 | 实验现象 | 结论 |
| 小强 | 剩余固体中一定含有 CaO(或氧化钙) 一定不含 CaC2O4(或草酸钙) 可能含有 CaCO3(或碳酸钙) | ||
| 小明 | 剩余固体中一定含有CaCO3(或碳酸钙) |
| ||
故答案为:t3~t4.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,学生应能根据图象和反应相结合来分析发生的化学反应与温度的关系,得出规律性的知识,加强了整合知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目