题目内容
(2013?南京)核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题:
(1)在第三周期中,各原子结构的共同之处是
(2)在第三周期中,元素类型的变化情况是:从左到右由
(3)写出核外电子排布与氖原子形同的阳离子和阴离子符号各一个:阳离子
(4)写出含有氮元素的常见氧化物、酸、碱、盐的化学式各一个:
| 第一周期 | 1H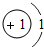 |
2He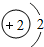 | ||||||
| 第二周期 | 3Li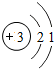 |
4Be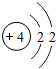 |
5B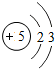 |
6C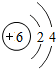 |
7N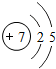 |
8O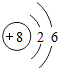 |
9F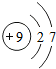 |
10Ne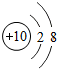 |
| 第三周期 | 11Na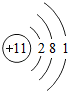 |
12Mg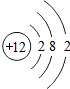 |
13Al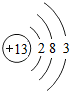 |
14Si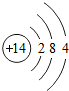 |
15P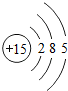 |
16S |
17Cl |
18Ar |
各原子的电子层数相同
各原子的电子层数相同
;该周期中,各原子核外电子排布的变化规律是最外层电子数依次递增
最外层电子数依次递增
.(2)在第三周期中,元素类型的变化情况是:从左到右由
金属
金属
元素过渡到非金属
非金属
元素,并以稀有气体元素结尾.(3)写出核外电子排布与氖原子形同的阳离子和阴离子符号各一个:阳离子
Na+
Na+
,阴离子O2-
O2-
.(4)写出含有氮元素的常见氧化物、酸、碱、盐的化学式各一个:
| 物质的类别 | 氧化物 | 酸 | 碱 | 盐 |
| 物质的化学式 | NO2 NO2 |
HNO3 HNO3 |
NH3?H2O NH3?H2O |
NH4NO3 NH4NO3 |
分析:(1)第三周期各原子电子层数都是3层;根据原子结构示意图中最外层电子数的变化关系考虑;
(2)根据最外层电子数小于4的一般是金属元素,最外层电子数多于或等于4属于非金属的特点分析解答;
(3)阳离子是带正电荷,阴离子是带负电荷,电子数等于10个就行;
(4)根据化学式的写法,氧化物是由两种元素组成,一种元素是氧元素的化合物,酸是电离出的阳离子都是氢离子的化合物,电离出金属离子(或铵根离子)和酸根离子的化合物属于盐,氨水属于碱.
(2)根据最外层电子数小于4的一般是金属元素,最外层电子数多于或等于4属于非金属的特点分析解答;
(3)阳离子是带正电荷,阴离子是带负电荷,电子数等于10个就行;
(4)根据化学式的写法,氧化物是由两种元素组成,一种元素是氧元素的化合物,酸是电离出的阳离子都是氢离子的化合物,电离出金属离子(或铵根离子)和酸根离子的化合物属于盐,氨水属于碱.
解答:解:(1)元素的周期数与原子的核外电子层数相同.第三周期各原子电子层数都是3层;原子结构示意图中最外层电子数由左向右依次递增;
(2)最外层电子数小于4的一般是金属元素,最外层电子数多于或等于4属于非金属,汉字中带钅字旁的属于金属元素(金和汞除外);由图示可知从左到右由金属元素过渡到非金属元素;
(3)氖原子是10个电子,阳离子是带正电荷,阴离子是带负电荷,所以钠离子属于阳离子,核外电子数是10个,符号为:Na+;氧离子带2个单位负电荷,属于阴离子,核外电子数也是10个;符号是O2-;
(4)氧化物是由两种元素组成,一种元素是氧元素的化合物,所以二氧化氮属于氧化物,化学式是NO2;酸是电离出的阳离子都是氢离子的化合物,硝酸就是酸,化学式是:HNO3;氨水属于弱碱,化学式是NH3?H2O;带铵根的盐属于铵盐,所以硝酸铵属于盐,化学式是NH4NO3.
故答案为:(1)各原子的电子层数相同;最外层电子数依次递增;(2)金属;非金属;(3)Na+;O2-;(4)
(2)最外层电子数小于4的一般是金属元素,最外层电子数多于或等于4属于非金属,汉字中带钅字旁的属于金属元素(金和汞除外);由图示可知从左到右由金属元素过渡到非金属元素;
(3)氖原子是10个电子,阳离子是带正电荷,阴离子是带负电荷,所以钠离子属于阳离子,核外电子数是10个,符号为:Na+;氧离子带2个单位负电荷,属于阴离子,核外电子数也是10个;符号是O2-;
(4)氧化物是由两种元素组成,一种元素是氧元素的化合物,所以二氧化氮属于氧化物,化学式是NO2;酸是电离出的阳离子都是氢离子的化合物,硝酸就是酸,化学式是:HNO3;氨水属于弱碱,化学式是NH3?H2O;带铵根的盐属于铵盐,所以硝酸铵属于盐,化学式是NH4NO3.
故答案为:(1)各原子的电子层数相同;最外层电子数依次递增;(2)金属;非金属;(3)Na+;O2-;(4)
| 物质的类别 | 氧化物 | 酸 | 碱 | 盐 |
| 物质的化学式 | NO2 | HNO3 | NH3?H2O | NH4NO3 |
点评:本题考查学生对原子结构示意图、元素周期律知识的理解与在解题中灵活应用的能力.

练习册系列答案
相关题目