题目内容
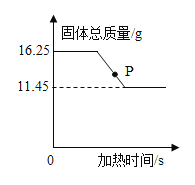
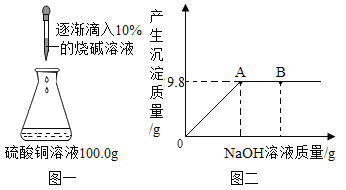
【题目】实验室中有一瓶未知浓度的硫酸铜熔液,为了测定其定量组成,小宇同学设计并进行了如图一所示的探究实验,图二为反应生成沉淀的质量与滴入氢氧化钠溶液质量的变化关系,发生反应的化学方程式为:![]()
根据上述信息,请你回答下列问题:
(1)图2中B点对应溶液里所含的溶质为______ (填化学式)。
(2)试计算:该硫酸铜溶液的溶质质量分数是多少______?
【答案】NaOH、Na2SO4 16%
【解析】
(1)图 2 中 B 点固体不再生成,说明氢氧化钠是过量的,对应溶液里所含的溶质为剩余的NaOH和生成的Na2SO4。
(2)设该硫酸铜溶液的溶质质量分数是x
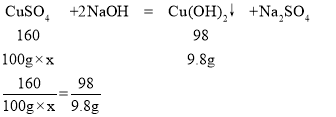
x=16%
答:该硫酸铜溶液的溶质质量分数是16%。
故答案为:
(1)NaOH、Na2SO4;
(2)16%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目