题目内容
小琴同学设计如右图所示的A、B两个实验
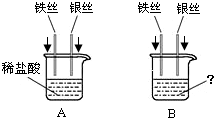
(1)实验时,她为了除去铁丝和银丝表面的氧化物或污物,其操作是 ;
(2)A实验目的是 ,实验时,将铁丝和银丝同时插入稀硫酸中,可观察到的现象是铁丝表面有气泡产生,银丝表面无明显现象,溶液由无色逐渐变为浅绿色;所发生反应的化学方程式为 ;
(3)B实验中,当烧杯内盛有 溶液时,可验证Fe、Ag三种金属活动性强弱。

(1)实验时,她为了除去铁丝和银丝表面的氧化物或污物,其操作是 ;
(2)A实验目的是 ,实验时,将铁丝和银丝同时插入稀硫酸中,可观察到的现象是铁丝表面有气泡产生,银丝表面无明显现象,溶液由无色逐渐变为浅绿色;所发生反应的化学方程式为 ;
(3)B实验中,当烧杯内盛有 溶液时,可验证Fe、Ag三种金属活动性强弱。
(1)用砂纸将铁丝和银丝表面打磨光亮;
(2)比较铁和银的金属活动性强弱,铁丝表面有气泡产生,溶液由无色变为浅绿色,而银丝表面无明显现象,Fe+H2SO4=FeSO4+H2↑
(3)CuSO4
(2)比较铁和银的金属活动性强弱,铁丝表面有气泡产生,溶液由无色变为浅绿色,而银丝表面无明显现象,Fe+H2SO4=FeSO4+H2↑
(3)CuSO4
(1)从实验室拿出来的铁丝和银丝表面是被空气中的氧气氧化过的,所以应该用砂纸将其表面打磨光亮。
故答案为:用砂纸将铁丝和银丝表面打磨光亮。
(2)在金属活动顺序表中氢前边的金属可以与稀硫酸反应,但氢以后的金属不会与稀硫酸反应,所以铁会与稀硫酸反应,但银不会与稀硫酸反应,铁与稀硫酸反应时生成氢气和硫酸亚铁溶液,因为Fe2+显绿色,所以观察到的现象是铁丝表面有气泡产生,溶液由无色变为浅绿色,而银丝表面无明显现象。
故答案为:比较铁和银的金属活动性强弱 铁丝表面有气泡产生,溶液由无色变为浅绿色,而银丝表面无明显现象Fe+H2SO4=FeSO4+H2↑
(3)金属活动顺序表中,前边的金属可以把后边的金属从其盐溶液中置换出来,所以可以在金属活动顺序表中在铁和银之间找一种金属的盐溶液,如硫酸铜溶液,把铁和银两种金属插入该盐的溶液中,铁可以把该金属从其盐溶液中置换出来,但银不会把该金属从其盐溶液中置换出来.故选CuSO4
故答案为:用砂纸将铁丝和银丝表面打磨光亮。
(2)在金属活动顺序表中氢前边的金属可以与稀硫酸反应,但氢以后的金属不会与稀硫酸反应,所以铁会与稀硫酸反应,但银不会与稀硫酸反应,铁与稀硫酸反应时生成氢气和硫酸亚铁溶液,因为Fe2+显绿色,所以观察到的现象是铁丝表面有气泡产生,溶液由无色变为浅绿色,而银丝表面无明显现象。
故答案为:比较铁和银的金属活动性强弱 铁丝表面有气泡产生,溶液由无色变为浅绿色,而银丝表面无明显现象Fe+H2SO4=FeSO4+H2↑
(3)金属活动顺序表中,前边的金属可以把后边的金属从其盐溶液中置换出来,所以可以在金属活动顺序表中在铁和银之间找一种金属的盐溶液,如硫酸铜溶液,把铁和银两种金属插入该盐的溶液中,铁可以把该金属从其盐溶液中置换出来,但银不会把该金属从其盐溶液中置换出来.故选CuSO4

练习册系列答案
相关题目

