题目内容
 2009年2月法国欲拍卖我圆明园兔首和鼠首两件文物(如图).
2009年2月法国欲拍卖我圆明园兔首和鼠首两件文物(如图).
这两件文物均为青铜器,其表面呈绿色,这是铜器长期暴露在空气中生成了碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222],俗称铜绿,又名孔雀石,是一种名贵的矿物宝石.化学兴趣小组的同学为了测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数,称取该铜矿样品30g,加入到132.2g稀盐酸时恰好完全反应,(杂质不与酸反应也不溶于水)共生成CO2气体4.4g.反应的化学方程式如下:
Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑
(1)根据铜绿的化学式,你认为铜绿的形成是铜与________、________和氧气共同作用的结果.
(2)铜矿样品中碱式碳酸铜的质量是多少克?其质量分数是多少?
(3)反应后所得溶液中溶质质量分数是多少?
答:(1)由铜绿的化学式可知Cu2(OH)2CO3,它由铜离子、氢氧根离子和碳酸根离子构成,因此可以判断铜绿的形成是铜与二氧化碳与水和氧气共同作用的结果.
故答案为:二氧化碳,水.
(2)解:设参与反应的Cu2(OH)2CO3的质量为x,生成CuCl2的质量为y,
Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑
222----------------270---------44
x-------------------y---------4.4g
∴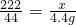 ,
,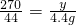
解之得:x=22.2g,y=27g,
铜矿样品中碱式碳酸铜的质量是22.2g;
铜矿样品中碱式碳酸铜的质量分数为: ×100%=74%.
×100%=74%.
(3)反应后所得溶液中溶质质量分数为: ×100%=18%.
×100%=18%.
答:(2)铜矿样品中碱式碳酸铜的质量分数为74%;
(3)反应后所得溶液中溶质质量分数为18%.
分析:(1)由铜绿的化学式可知Cu2(OH)2CO3,它由铜离子、氢氧根离子和碳酸根离子构成,二氧化碳中有C、O元素,水中有H、O元素,因此可以判断铜绿的形成是铜与二氧化碳与水和氧气共同作用的结果;
(2)根据碱式碳酸铜与盐酸反应的化学方程式和生成的气体的质量,列出比例式,即可计算出参与反应的Cu2(OH)2CO3的质量和生成CuCl2的质量;然后根据质量分数公式计算即可;
(3)反应后溶液中的溶质是CuCl2,利用(2)中求出的生成CuCl2的质量,根据溶质质量分数= ×100%计算即可.
×100%计算即可.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.
故答案为:二氧化碳,水.
(2)解:设参与反应的Cu2(OH)2CO3的质量为x,生成CuCl2的质量为y,
Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑
222----------------270---------44
x-------------------y---------4.4g
∴
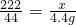 ,
,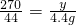
解之得:x=22.2g,y=27g,
铜矿样品中碱式碳酸铜的质量是22.2g;
铜矿样品中碱式碳酸铜的质量分数为:
 ×100%=74%.
×100%=74%.(3)反应后所得溶液中溶质质量分数为:
 ×100%=18%.
×100%=18%.答:(2)铜矿样品中碱式碳酸铜的质量分数为74%;
(3)反应后所得溶液中溶质质量分数为18%.
分析:(1)由铜绿的化学式可知Cu2(OH)2CO3,它由铜离子、氢氧根离子和碳酸根离子构成,二氧化碳中有C、O元素,水中有H、O元素,因此可以判断铜绿的形成是铜与二氧化碳与水和氧气共同作用的结果;
(2)根据碱式碳酸铜与盐酸反应的化学方程式和生成的气体的质量,列出比例式,即可计算出参与反应的Cu2(OH)2CO3的质量和生成CuCl2的质量;然后根据质量分数公式计算即可;
(3)反应后溶液中的溶质是CuCl2,利用(2)中求出的生成CuCl2的质量,根据溶质质量分数=
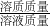 ×100%计算即可.
×100%计算即可.点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2009年2月法国欲拍卖我圆明园兔首和鼠首两件文物(如图).
2009年2月法国欲拍卖我圆明园兔首和鼠首两件文物(如图).

