题目内容
【题目】毛巾用久了会变硬变黄,原因之一是;用毛巾洗脸时,自来水中的钙、镁离子与肥皂作用产生沉淀物(沉淀物可溶于酸)吸附于毛巾上,
(1)根据要求回答问题.
①钙离子可用化学符号表示为 .
②证明自来水是硬水,可使用的试剂是 ,观察到的现象是 .
③为避免或减缓毛巾变硬变黄,一种方法是降低自来水的硬度.
下列水净化的方法,一定可以降低水的硬度的是 ;
A.过滤 B.沉降 C.蒸馏 D.吸附
④要让用久的毛巾变软,日常生活中可采用的一条措施是 .
(2)锰及其化合物在生产中有重要作用,有如下反应:
A.3MnO2+4Al![]() 3Mn+2Al2O3;
3Mn+2Al2O3;
B.2MnO2+O2+4KOH═2K2MnO4+2H2O
C.3K2MnO4+2H2SO4═2KMnO4+2K2SO4+X+2H2O
请回答下列问题:
①反应C中X的化学式为 .在上述反应中,反应前后锰元素化合价只升高不降低的是 .(填序号)
②加热氯酸钾与MnO2的混合物可制得氧气.反应的化学方程式是 .
③MnO2是制作超级电容器的材料.MnSO4溶液与锰酸钾溶液发生反应生成MnO2和硫酸钾,反应的化学方程式是 .
(3)A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去).
①若A是紫红色金属,D为难溶性碱.则D的化学式为 ,由C转化为A的化学方程式为 .
②已知A属于氧化物,其相对分子质量为56,A与水化合得B,C是白色难溶固体.则A的一种用途是 ,由D转化为C的化学方程式为 .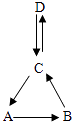
【答案】
(1)Ca2+;肥皂水;出现泡沫少,浮渣多;C;用食醋浸泡
(2)MnO2;B;2KClO3 ![]() 2KCl+3O2↑;MnSO4+K2MnO4═2MnO2+K2SO4
2KCl+3O2↑;MnSO4+K2MnO4═2MnO2+K2SO4
(3)Cu(OH)2;CuSO4+Fe═Cu+FeSO4(或CuCl2+Zn═Cu+ZnCl2等);做干燥剂等;CaCl2+Na2CO3═CaCO3↓+2NaCl[或CO2+Ca(OH)2═CaCO3↓+H2O等
【解析】解:(1)①由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故钙离子可表示为:Ca2+ . 故填:Ca2+;②向自来水水样中分别加入肥皂水,振荡,泡沫多的是软水,泡沫少、浮渣多的是硬水.故填:肥皂水;出现泡沫少,浮渣多;③降低水的硬度就是要除掉水中的钙离子、镁离子,只有蒸馏可以除去水的其他杂质,将硬水转化为软水,故填:C;④毛巾变硬是因为毛巾上覆盖了碳酸钙沉淀,可用食醋浸泡,碳酸钙与醋酸反应生成了可溶性的醋酸钙,故填:用食醋浸泡;2)①根据反应前后原子个数种类守恒,可知X的化学式为MnO2;反应前后锰元素化合价只升高不降低的是②,①中Mn化合价由+4→0,②Mn化合价由+4→+6,③中化合价既有升的又有降的;所以答案是:MnO2;B;②氯酸钾制氧气的反应是氯酸钾在二氧化锰的作用下产生氯化钾和氧气,故反应的方程式为:2KClO3 ![]() 2KCl+3O2↑;③MnSO4溶液与锰酸钾溶液发生反应生成MnO2和K2SO4 , 故其化学方程式为:MnSO4+K2MnO4═2MnO2+K2SO4 . (3)①A是紫红色金属,因此A是铜,A、B、C、D均含有同一种元素,D为难溶性碱,因此D是氢氧化铜,化学式为:Cu(OH)2;由于C能够和氢氧化铜相互转化,且C能够转化为铜,因此C是铜的盐溶液,如硫酸铜、氯化铜等,因此由C转化为A可以是铁与硫酸铜等发生置换反应,反应的方程式为:CuSO4+Fe═Cu+FeSO4(或CuCl2+Zn═Cu+ZnCl2等);②A属于氧化物,其相对分子质量为56,则A为氧化钙,氧化钙可以作为干燥剂;A与水化合得B,B是氢氧化钙;C是白色难溶固体,因此C是碳酸钙,D和碳酸钙能相互转化,D可以是钙盐,也可以是二氧化碳,由D转化为C是产生碳酸钙的反应,因此可以是 CaCl2+Na2CO3═CaCO3↓+2NaCl[或CO2+Ca(OH)2═CaCO3↓+H2O等];
2KCl+3O2↑;③MnSO4溶液与锰酸钾溶液发生反应生成MnO2和K2SO4 , 故其化学方程式为:MnSO4+K2MnO4═2MnO2+K2SO4 . (3)①A是紫红色金属,因此A是铜,A、B、C、D均含有同一种元素,D为难溶性碱,因此D是氢氧化铜,化学式为:Cu(OH)2;由于C能够和氢氧化铜相互转化,且C能够转化为铜,因此C是铜的盐溶液,如硫酸铜、氯化铜等,因此由C转化为A可以是铁与硫酸铜等发生置换反应,反应的方程式为:CuSO4+Fe═Cu+FeSO4(或CuCl2+Zn═Cu+ZnCl2等);②A属于氧化物,其相对分子质量为56,则A为氧化钙,氧化钙可以作为干燥剂;A与水化合得B,B是氢氧化钙;C是白色难溶固体,因此C是碳酸钙,D和碳酸钙能相互转化,D可以是钙盐,也可以是二氧化碳,由D转化为C是产生碳酸钙的反应,因此可以是 CaCl2+Na2CO3═CaCO3↓+2NaCl[或CO2+Ca(OH)2═CaCO3↓+H2O等];
所以答案是:①Cu(OH)2;CuSO4+Fe═Cu+FeSO4(或CuCl2+Zn═Cu+ZnCl2等);②做干燥剂等;CaCl2+Na2CO3═CaCO3↓+2NaCl[或CO2+Ca(OH)2═CaCO3↓+H2O等].
【考点精析】通过灵活运用硬水与软水和质量守恒定律及其应用,掌握硬水和软水的鉴别方法:用肥皂水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水;①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏即可以解答此题.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案