题目内容
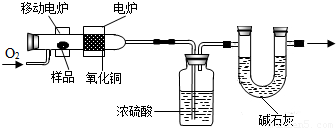
科学实验上测定有机物中碳元素和氢元素的含量,最常用的方法是燃烧分析法.即把已知量的样品置于氧气流中,用氧化铜作催化剂,在750℃左右,样品全部被氧化为二氧化碳和水.实验装置如图所示:现把43.2g某碳氢化合物(其相对分子质量为72),通过如图所示装置在氧气中充分燃烧,当分别称量盛有浓硫酸和碱石灰(可以吸收酸性气体)的两个装置时,发现它们的质量依次增加了64.8g和132.0g,通过计算确定该碳氢化合物的化学式.
【答案】分析:(1)浓硫酸具有干燥剂的作用,可吸收水分.其增加了64.8g,则为水的质量,则可求氢元素的质量.
(2)碱石灰可以吸收酸性气体,其增加了132.0g,则为二氧化碳的质量,则可求碳元素的质量.
(3)由碳、氢元素的质量比,可计算确定该碳氢化合物的化学式.
解答:解:设该碳氢化合物的化学式为CxHy,(1)氢元素的质量为64.8g×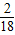 ×100%=7.2g,(2)碳元素的质量为132.0g×
×100%=7.2g,(2)碳元素的质量为132.0g×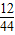 ×100%=36g,则12x/y=36/7.2,所以x/y=5/12,则该碳氢化合物的化学式为C5H12.
×100%=36g,则12x/y=36/7.2,所以x/y=5/12,则该碳氢化合物的化学式为C5H12.
答:通过计算确定该碳氢化合物的化学式为C5H12.
点评:理解化学式中各元素的质量计算,各元素的原子的相对原子质量比也就是实际质量的比.
(2)碱石灰可以吸收酸性气体,其增加了132.0g,则为二氧化碳的质量,则可求碳元素的质量.
(3)由碳、氢元素的质量比,可计算确定该碳氢化合物的化学式.
解答:解:设该碳氢化合物的化学式为CxHy,(1)氢元素的质量为64.8g×
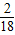 ×100%=7.2g,(2)碳元素的质量为132.0g×
×100%=7.2g,(2)碳元素的质量为132.0g×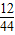 ×100%=36g,则12x/y=36/7.2,所以x/y=5/12,则该碳氢化合物的化学式为C5H12.
×100%=36g,则12x/y=36/7.2,所以x/y=5/12,则该碳氢化合物的化学式为C5H12.答:通过计算确定该碳氢化合物的化学式为C5H12.
点评:理解化学式中各元素的质量计算,各元素的原子的相对原子质量比也就是实际质量的比.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
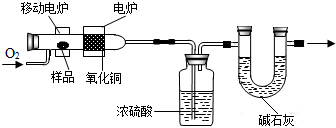 科学实验上测定有机物中碳元素和氢元素的含量,最常用的方法是燃烧分析法.即把已知量的样品置于氧气流中,用氧化铜作催化剂,在750℃左右,样品全部被氧化为二氧化碳和水.实验装置如图所示:
科学实验上测定有机物中碳元素和氢元素的含量,最常用的方法是燃烧分析法.即把已知量的样品置于氧气流中,用氧化铜作催化剂,在750℃左右,样品全部被氧化为二氧化碳和水.实验装置如图所示: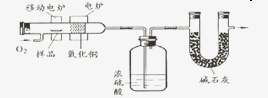
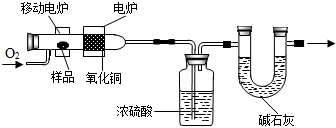 科学实验上测定有机物中碳元素和氢元素的含量,最常用的方法是燃烧分析法.即把已知量的样品置于氧气流中,用氧化铜作催化剂,在750℃左右,样品全部被氧化为二氧化碳和水.实验装置如图所示:
科学实验上测定有机物中碳元素和氢元素的含量,最常用的方法是燃烧分析法.即把已知量的样品置于氧气流中,用氧化铜作催化剂,在750℃左右,样品全部被氧化为二氧化碳和水.实验装置如图所示: