题目内容
【题目】空气中氧气含量测定的再认识。
【实验回顾】实验室用红磷燃烧来测定空气中氧气含量。
(1)写出红磷燃烧的化学方程式。
(2)实验原理:红磷燃烧消耗氧气,使瓶内减小,烧杯中水倒吸到集气瓶。若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
(3)对该实验认识正确的是
A.红磷燃烧产生大量白色的烟雾
B.红磷的用量不足会导致测定氧气体积含量偏大
C.红磷燃烧以后,须冷却到室温方可打开止水夹
D.该实验可说明N2难溶于水
(4)【发现问题】测量结果仍与理论值误差较大。
有资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧。
【实验改进】
根据铁在空气中生锈的原理设计右图实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。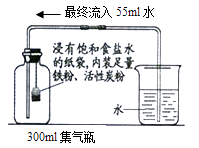
对此改进实验的叙述,错误的是
A.此实验的原理是利用铁生锈消耗氧气
B.实验前一定要检查装置的气密性
C.此实验中铁粉的多少不影响测量结果
D.此实验测出氧气的体积分数为18.3%
【答案】
(1)4P+5O2 ![]() 2P2O5
2P2O5
(2)压强
(3)C、D
(4)C
【解析】(1)红磷燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2 ![]() 2P2O5;
2P2O5;
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内气体的压强减小,烧杯中水倒吸到集气瓶;
(3)实验过程中的现象:红磷燃烧产生大量白色的烟雾;红磷的用量不足、装置漏气、冷却到室温打开止水夹等会导致测定氧气体积含量偏小;同时说明剩余的气体难溶于水,不燃烧;故答案为:CD;
(4)从实验原理角度分析,改进实验准确度更髙的主要原因是:铁的缓慢氧化使集气瓶中的氧气消耗更为彻底,使实验结果更准确,故A正确;实验前一定要检查装置的气密性,故B正确;此实验中铁粉的量不足会使测量结果偏小,故C错误;此实验测出氧气的体积分数为![]() ×100%≈18.3%,故正确。故答案为:C.
×100%≈18.3%,故正确。故答案为:C.
红磷和氧气燃烧生成五氧化二磷,据此书写化学方程式;红磷燃烧消耗了氧气生成了五氧化二磷固体造成瓶内压强减小。实验现象:红磷燃烧,产生大量白烟、放热、 冷却后打开弹簧夹,水沿着导管进入集气瓶中,进入集气瓶内水的体积约占集气瓶空气总体积的1/5。实验注意事项:红磷必须过量。如果红磷的量不足,集气瓶内的氧气没有被完全消耗,测量结果会偏小。装置气密性要好。如果装置的气密性不好,集气瓶外的空气进入集气瓶,测量结果会偏小。导管中要注满水。否则当红磷燃烧并冷却后,进入的水会有一部分残留在试管中,导致测量结果偏小。冷却后再打开弹簧夹,否则测量结果偏小。如果弹簧夹未夹紧,或者塞塞子的动作太慢,测量结果会偏大。红磷会在剩余的气体中熄灭,所以剩余的气体(主要是氮气),难溶于水,不燃烧,不支持燃烧;改进实验中为了使集气瓶中的氧气消耗干净,同样需要过量的铁粉与氧气和水发生缓慢氧化,从而把氧气消耗完,才能使实验数据准确;

【题目】空气和水是人类赖以生存的自然资源。 (本题涉及到的物质均用化学式填写):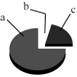
(1)氮气、氧气、氦气和二氧化碳都是空气的成分。
图中a代表的气体是;引起温室效应的是;通电时发出有色光的是;供给呼吸的是。
(2)空气中主要组分的沸点如下表:
组分 | 氮气 | 氧气 | 二氧化碳 |
沸点(℃) | -195.8 | -183.0 | -78.5 |
空气是工业上制取大量氧气的原料,工业制氧气属于变化(填“物理”或“化学”)。将液态空气升温至-195℃,收集逸出的物质,此时逸出的物质主要是;继续升温至-183℃,逸出的物质能使带火星的木条复燃,此时逸出的物质主要是。





