题目内容
今有氢氧化钠、碳酸氢钠以及与其他物质都不反应、受热也不分解的杂质组成的固体混合物17.110g,放入密闭容器中加热至250℃,经充分反应后,将容器中的气体通入过量的澄清石灰水中得到白色沉淀2.500g,当容器中的残留固体冷却到室温后,全部溶于水制成50mL 溶液.从中取出10.00mL,恰好可与含HCl 1.825g 盐酸溶液25.00mL 中和至中性,求原混合物中含杂质的质量分数.
解:设气体二氧化碳的质量为x
Ca(OH)2+CO2=CaCO3↓+H2O
44 100
x 2.500g

x=1.100g
设碳酸氢钠的质量为y,生成碳酸钠的质量为z
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
168 106 44
y z 1.100g
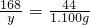 y=4.200g
y=4.200g
 z=2.650g
z=2.650g
设与1.825gHCl恰好完全反应的碳酸钠的质量为a
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
a 1.825g

a=2.650g
则冷却到室温后残留固体中碳酸钠的质量=2.650g×5=13.250g,其中由氢氧化钠与碳酸氢钠反应生成碳酸钠的质量=13.250g-2.650g=10.600g
设氢氧化钠与碳酸氢钠反应生成10.600g碳酸钠的同时生成水的质量为b
NaOH+NaHCO3=Na2CO3+H2O
106 18
10.600g b

b=1.800g
根据质量质量守恒定律,氢氧化钠和碳酸氢钠的质量=10.600g+1.800g=12.400g
混合物中所含杂质的质量分数=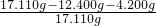 ×100%≈2.98%
×100%≈2.98%
答:原混合物中含杂质的质量分数约为2.98%.
分析:氢氧化钠、碳酸氢钠放入密闭容器中加热至250℃,氢氧化钠与碳酸氢钠反应生成碳酸钠和水,过量的碳酸氢钠分解生成碳酸钠、水和二氧化碳;生成的二氧化碳与能澄清石灰水生成碳酸钙沉淀,因此,利用沉淀碳酸钙的质量可计算放出气体二氧化碳的质量,再由二氧化碳的质量可计算出分解的碳酸氢钠的质量及生成的碳酸钠的质量;
根据溶液的均一性,从50mL溶液取出10mL溶液时,溶液中溶质质量也为原溶质质量的 ;
;
碳酸钠溶液呈碱性,与盐酸完全反应生成氯化钠和水,溶液呈中性;利用反应消耗盐酸的质量计算出加热后残留固体中碳酸钠的质量,用其质量减去碳酸氢分解产生的碳酸钠,所得碳酸钠质量即为氢氧化钠与碳酸氢钠反应所生成碳酸钠质量,由此计算混合物中氢氧化钠与碳酸氢钠的质量;
最后使用混合物的质量减去氢氧化钠和碳酸氢钠的质量即可求得混合物中杂质质量,杂质质量与混合物质量比求出混合物中所含杂质的质量分数.
点评:在解答本题时需要注意到氢氧化钠与碳酸氢钠的混合时反应生成碳酸钠和水,而当碳酸氢钠过量时加热才会分解出二氧化碳气体.
Ca(OH)2+CO2=CaCO3↓+H2O
44 100
x 2.500g

x=1.100g
设碳酸氢钠的质量为y,生成碳酸钠的质量为z
2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑168 106 44
y z 1.100g
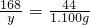 y=4.200g
y=4.200g z=2.650g
z=2.650g设与1.825gHCl恰好完全反应的碳酸钠的质量为a
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
a 1.825g

a=2.650g
则冷却到室温后残留固体中碳酸钠的质量=2.650g×5=13.250g,其中由氢氧化钠与碳酸氢钠反应生成碳酸钠的质量=13.250g-2.650g=10.600g
设氢氧化钠与碳酸氢钠反应生成10.600g碳酸钠的同时生成水的质量为b
NaOH+NaHCO3=Na2CO3+H2O
106 18
10.600g b

b=1.800g
根据质量质量守恒定律,氢氧化钠和碳酸氢钠的质量=10.600g+1.800g=12.400g
混合物中所含杂质的质量分数=
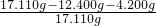 ×100%≈2.98%
×100%≈2.98%答:原混合物中含杂质的质量分数约为2.98%.
分析:氢氧化钠、碳酸氢钠放入密闭容器中加热至250℃,氢氧化钠与碳酸氢钠反应生成碳酸钠和水,过量的碳酸氢钠分解生成碳酸钠、水和二氧化碳;生成的二氧化碳与能澄清石灰水生成碳酸钙沉淀,因此,利用沉淀碳酸钙的质量可计算放出气体二氧化碳的质量,再由二氧化碳的质量可计算出分解的碳酸氢钠的质量及生成的碳酸钠的质量;
根据溶液的均一性,从50mL溶液取出10mL溶液时,溶液中溶质质量也为原溶质质量的
 ;
;碳酸钠溶液呈碱性,与盐酸完全反应生成氯化钠和水,溶液呈中性;利用反应消耗盐酸的质量计算出加热后残留固体中碳酸钠的质量,用其质量减去碳酸氢分解产生的碳酸钠,所得碳酸钠质量即为氢氧化钠与碳酸氢钠反应所生成碳酸钠质量,由此计算混合物中氢氧化钠与碳酸氢钠的质量;
最后使用混合物的质量减去氢氧化钠和碳酸氢钠的质量即可求得混合物中杂质质量,杂质质量与混合物质量比求出混合物中所含杂质的质量分数.
点评:在解答本题时需要注意到氢氧化钠与碳酸氢钠的混合时反应生成碳酸钠和水,而当碳酸氢钠过量时加热才会分解出二氧化碳气体.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目